
| A. | 标准状况下,22.4LH2O含有的分子数为1NA | |
| B. | 常温常压下,7.1g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,1L溶液中含有Cl-个数为1 NA |
分析 A、标况下水为液体;
B、求出氯气的物质的量,然后根据氯气反应后变为-1价来分析;
C、通常状态下,气体摩尔体积大于22.4L/mol;
D、求出氯化镁的物质的量,然后根据1mol氯化镁中含2mol氯离子来分析.
解答 解:A、标况下水为液体,故根据气体摩尔体积来计算其物质的量,故A错误;
B、7.1g氯气的物质的量为0.1mol,而氯气反应后变为-1价,故0.1mol氯气和铁反应转移0.2NA个电子,故B错误;
C、通常状态下,气体摩尔体积大于22.4L/mol,故NA个二氧化碳分子即1mol二氧化碳的体积大于22.4L,故C错误;
D、溶液中氯化镁的物质的量n=CV=0.5mol/L×1L=0.5mol,而1mol氯化镁中含2mol氯离子,故0.5mol氯化镁中含NA个氯离子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | KSCN | B. | 氨水 | C. | 盐酸 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清晨的阳光穿过茂密的林木枝叶所产生的美丽的光线 | |
| B. | 向FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 | |
| C. | 肾功能衰竭等疾病引起的尿中毒,可利用半透膜进行血液透析 | |
| D. | 在海水与河水交界处,易形成三角洲 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
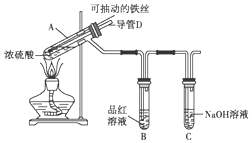
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  CH3+Cl2$\stackrel{光照}{→}$ CH3+Cl2$\stackrel{光照}{→}$ CH2Cl+HCl CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$ 2CH3CHO+2H2O | |
| C. | ClCH2═CH2+NaOH$→_{△}^{水}$ HOCH2CH═CH2+NaCl | |
| D. |  +HONO2$→_{△}^{浓硫酸}$ +HONO2$→_{△}^{浓硫酸}$ NO2+H2O NO2+H2O |
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:填空题
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1 )2NO(g)+2CO(g)
)2NO(g)+2CO(g) 2CO2(g)+N2(g)△H=﹣746.5kJ•mol-1(条件为使用催化剂)
2CO2(g)+N2(g)△H=﹣746.5kJ•mol-1(条件为使用催化剂)
已知:2C(s)+O2(g) 2CO(g)△H=﹣221.0kJ•mol-1
2CO(g)△H=﹣221.0kJ•mol-1
C(s)+O2(g) CO2(g)△H=﹣393.5kJ•mol-1
CO2(g)△H=﹣393.5kJ•mol-1
则N2(g)+O2(g)=2NO(g) △H = kJ•mol-1。
(2)T ℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
则c2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O) αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比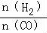 的变化曲线如图1所示。
的变化曲线如图1所示。

① a、b、c按从大到小的顺序排序为 。
② 根据图象可以判断该反应为 反应(填吸热或放热)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池 ,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
① 负极的电极反应式为 。
② 以上述电池为电源,通过导线连接成图2。若X、Y为石墨,a为2 L 0.1 mol/L KCl溶液电解一段时间后,取25 mL 上述电解后的溶液,滴加0.4 mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图2计算,上述电解过程中消耗一氧化碳的质量为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com