
在密闭容器中进行下列反应:
CO2(g)+C(s)⇌2CO(g)△H>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
(1)增加C,平衡 ,c(CO) .
(2)减小密闭容器的体积,保持温度不变,则平衡 ,c(CO2) .
(3)通入N2,保持密闭容器的体积和温度不变,则平衡 ,c(CO2) .
(4)保持密闭容器的体积不变,升高温度,则平衡 ,c(CO)
(5)恒压通入N2,CO2的百分含量
(6)恒压再通入2molCO,CO2的百分含量 .
考点:
化学平衡的计算.
分析:
根据平衡移动的原理,增加反应物浓度平衡正向移动,改变固体或纯液体的量平衡不移动,升高温度平衡向吸热的方向移动,增大压强平衡向体积减小的方向移动,恒压通CO可以用等效平衡的思想解决,据此答题;
解答:
解:(1)因为C为固体,所以增加C,平衡不移动,一氧化碳的浓度不变,故答案为:不移动,不变;
(2)由于该反应是气体体积增大的反应,所以减小密闭容器的体积,保持温度不变,压强增大,平衡逆向移动,二氧化碳的浓度增大,故答案为:逆移;增大;
(3)通入N2,保持密闭容器的体积和温度不变,参加反应的各物质的浓度都不变,所以平衡不移动,二氧化碳的浓度不变,故答案为:不移;不变;
(4)由于该反应是吸热反应,升高温度,则平衡向正反应方向移动,一氧化碳的浓度增大,故答案为:正移;增大;
(5)恒压通入N2,则容器体积增大,相当于减压,平衡正向移动,CO2的百分含量减小,故答案为:减小;
(6)恒压再通入2molCO,平衡时则可以形成与原平衡为等效平衡的体系,所以CO2的百分含量不变,故答案为:不变;
点评:
本题主要考查了影响平衡移动的外界因素,以及平衡移动后有关物理量的变化情况,难度不大,注重基础知识的应用.


科目:高中化学 来源: 题型:
在恒温恒容条件下,能使反应:A(g)+B(g)⇌C(g)+D(g)的正反应速率增大的是( )
|
| A. | 减小C的浓度 | B. | 减小D的浓度 | C. | 减小B的浓度 | D. | 增大A的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
50mL0.001mol/L盐酸的pH=
50mL0.001mol/LNaOH溶液的pH=
100℃时,水的Kw=1×10﹣12,则该温度下,纯水的pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种含氨和氯化铵物质的量相等的混合溶液,其pH为9.3,下列说法中错误的是( )
|
| A. | 氨水的电离作用大于氯化铵的水解作用 |
|
| B. | 氯化铵的水解作用大于氨水的电离作用 |
|
| C. | 氨水的存在抑制了氯化铵的水解 |
|
| D. | 氯化铵的存在抑制了氨水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用CO生产甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g).图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图.下列叙述错误的是( )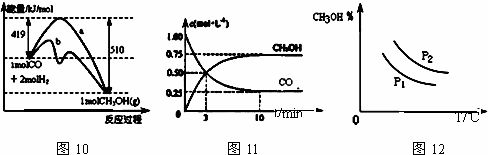
|
| A. | CO和H2合成CH3OH的反应:△H<0,△S>0 |
|
| B. | 保持温度不变,再充入1mol CO和2mol H2,反应达到新平衡时 |
|
| C. | 图10中曲线b可表示使用了催化剂的能量变化情况 |
|
| D. | 图12中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
摩尔浓度相同的三种盐NaX、NaY和NaZ的溶液,其中pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
|
| A. | HX、HZ、HY | B. | HZ、HY、HX | C. | HX、HY、HZ | D. | HY、HZ、HX |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于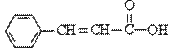 的下列说法中正确的是
的下列说法中正确的是
A.分子式为C9H9O2
B.含有三种官能团
C.可使溴的四氯化碳溶液或酸性KMnO4溶液褪色
D.可以发生取代反应和加成反应,但不能发生聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
|
| A. | 相同浓度的两溶液中c(H+)相同 |
|
| B. | 100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠 |
|
| C. | pH=3的两溶液稀释100倍,pH都为5 |
|
| D. | 两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com