
| A、Ba(OH)2?8H2O与NH4Cl反应 |
| B、铝与稀盐酸反应 |
| C、灼热的炭与CO2反应 |
| D、甲烷与O2的燃烧反应 |


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
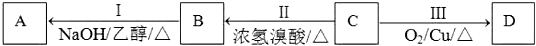
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 Fenton法常用于处理含难降解有机物的工业废水,通常先调节好Fe2+等离子的浓度,再向废水中加入H2O2,所产生的羟基自由基(Fe2++H2O2→Fe3++OH-+HO?)能氧化降解污染物.如:降解废水中丙二醇(分子式C3H8O2)的反应为:C3H8O2+8H2O2
Fenton法常用于处理含难降解有机物的工业废水,通常先调节好Fe2+等离子的浓度,再向废水中加入H2O2,所产生的羟基自由基(Fe2++H2O2→Fe3++OH-+HO?)能氧化降解污染物.如:降解废水中丙二醇(分子式C3H8O2)的反应为:C3H8O2+8H2O2| FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH不变,有氢气放出 |
| B、溶液的pH增大,有氧气放出 |
| C、溶液中Na+数目减小,有氧气放出 |
| D、溶液中c(Na+)增大,有氧气放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了如图所示装置和实验方案.实验步骤如下:
某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了如图所示装置和实验方案.实验步骤如下:| 序号 | 改进意见 | 缺少时的影响 |
| ① | ||
| ② | ||
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鉴别Na2CO3溶液和NaHCO3溶液常用的试剂是澄清石灰水 |
| B、(NH4)2SO4、K2SO4、NH4Cl三种物质不能用一种试剂通过化学反应区别开 |
| C、可以用BaCl2溶液和稀硝酸检验Na2SO3是否变质 |
| D、用湿润的KI淀粉试纸可以检验氯化氢气体中是否含有氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com