
| A、NH4+、NO3-、Cl-、Na+ |
| B、K+、SO32-、Cl-、NO3- |
| C、Na+、SO42-、Cl-、HCO3- |
| D、Na+、NO3-、K+、SO32- |


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| t | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
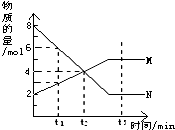 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:2N?M |
| B、Bt2时,正逆反应速率相等,达到平衡 |
| C、t1时,N的浓度是M的浓度的2倍 |
| D、t3时,正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、①④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂属于酯类 |
| B、天然油脂大多为单甘油酯 |
| C、油脂都不能使溴水或酸性高锰酸钾溶液褪色 |
| D、油脂在常温下的存在状态主要决定于分子中碳原子数的多少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com