
| A. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| B. | 还原性强弱:F-<Cl-<Br-<I- | |
| C. | 核外电子排布相同的微粒化学性质一定相同 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
分析 A.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大;
B.非金属性越强,阴离子还原性越弱;
C.核外电子排布相同的微粒化学性质不一定相同,如Ar与K+、S2-;
D.应是同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱.
解答 解:A.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故原子半径:S2->Cl->K+>Ca2+,故A错误;
B.非金属性F>Cl>Br>I,非金属性越强,阴离子还原性越弱,故还原性强弱:F-<Cl-<Br-<I-,故B错误;
C.核外电子排布相同的微粒化学性质不一定相同,如Ar与K+、S2-,Ar化学性质稳定,K+具有氧化性,S2-具有还原性,故C错误;
D.应是同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱,不是最高价含氧酸则酸性不一定,若次氯酸为弱酸,高溴酸为强酸,故D错误,
故选:B.
点评 本题考查元素周期律应用,难度不大,需要学生熟练掌握元素周期律,注意掌握微粒半径比较.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液是电解质 | |
| B. | 因为醋酸是弱电解质,所以醋酸在熔融状态下和在溶液中都不能导电 | |
| C. | 在氢气还原氧化铜的实验中,氢气是氧化剂 | |
| D. | 胶体的本质特征是粒子大小在1nm-100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
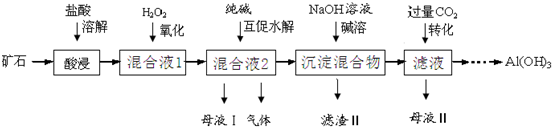
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
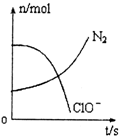 容器中发生一化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
容器中发生一化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 还原剂是含CN-的物质,氧化产物只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 氧化剂与还原剂的化学计量数之比为5:2 | |
| D. | 若生成2.24LN2,则转移电子必定为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对固体表面的化学过程的研究,有助于理解各种不同的过程.
对固体表面的化学过程的研究,有助于理解各种不同的过程.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com