
【题目】氮氧化铝(AlON)具有多晶陶瓷在材料制备方面的优势,有着广阔的应用前景。工业上利用某铝土矿(含Al2O3及少量的MgO等杂质)生产氮氧化铝的流程如图所示。回答下列问题:
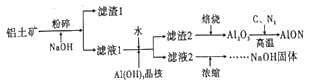
(1)为提高铝土矿碱浸的速率,除粉碎外,还可以采取的措施是_____(写出一项即可)
(2)滤液1的溶质有NaOH、_____。滤渣2的成分是_____。向滤液1中加水的目的是_______。该过程也可用通入足量的_____气体的方法来代替。
(3)滤液2浓缩的过程中常会吸收空气中的CO2,为得到纯净的NaOH,需要加入适量____(填化学式)。整个流程中,可循环的物质是_____。
(4)写出制备AlON的化学方程式_______。
(5)取1吨Al2O3质量分数为91.8%的铝土矿样品,利用上述流程AlON,最终制得氮氧化铝820.8kg,则氮氧化铝的产率为______。
【答案】升温 NaAlO2 Al(OH)3 促进NaAlO2的水解 CO2 Ca(OH)2 NaOH Al2O3+C+N2![]() 2AlON+CO 80%
2AlON+CO 80%
【解析】
(1)考查影响反应速率的因素,提高碱浸的速率,除粉碎外,还可以升高温度等;
答案为升高温度;
(2)铝土矿成分是Al2O3和MgO,其中MgO为碱性氧化物,不与NaOH反应,Al2O3为两性氧化物,发生Al2O3+2NaOH=2NaAlO2+H2O,为了让Al2O3充分反应,所加NaOH过量,即滤液1中溶质为NaOH和NaAlO2,滤渣1为MgO等不溶杂质;根据流程,滤渣2焙烧得到Al2O3,即滤渣2为Al(OH)3;根据流程,滤液2经过一系列变化后得到NaOH溶液,即滤液2中溶质主要是NaOH,即加水:NaAlO2+2H2O![]() Al(OH)3+NaOH,加水促进水解,因此加水的目的是促进NaAlO2的水解;利用碳酸的酸性强于Al(OH)3,以及Al(OH)3不溶于碳酸,因此该过程也可用足量的CO2气体来代替;
Al(OH)3+NaOH,加水促进水解,因此加水的目的是促进NaAlO2的水解;利用碳酸的酸性强于Al(OH)3,以及Al(OH)3不溶于碳酸,因此该过程也可用足量的CO2气体来代替;
答案是NaAlO2;Al(OH)3;促进NaAlO2的水解;CO2;
(3)NaOH溶液吸收空气中CO2,转化成Na2CO3,为了得到纯净的NaOH,需要除去CO32-,因此需要加入适量的Ca(OH)2,根据流程循环使用的物质是NaOH;
答案是Ca(OH)2;NaOH;
(4)根据流程,Al2O3与C、N2发生反应,高温下,C一般转化成CO,其反应方程式为Al2O3+C+N2![]() =2AlON+CO;
=2AlON+CO;
答案是Al2O3+C+N2![]() =2AlON+CO;
=2AlON+CO;
(5)利用铝原子守恒,理论上得到AlON的质量为![]() ,产率为
,产率为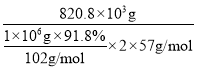 ×100%=80%;
×100%=80%;
答案是80%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)合成氨工业对国民经济和社会发展具有重要意义,对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0。写出该反应化学平衡常数表达式_______,升高温度,该反应化学反应速率_______,氢气的转化率_______ (以上均填“增大”、“减小”或“不变”)。实际生产中温度一般控制在500℃,原因是_______。
2NH3(g) ΔH<0。写出该反应化学平衡常数表达式_______,升高温度,该反应化学反应速率_______,氢气的转化率_______ (以上均填“增大”、“减小”或“不变”)。实际生产中温度一般控制在500℃,原因是_______。
(2)在500℃下合成甲醇的反应原理为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1molCO2和3molH2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1molCO2和3molH2,压强为p0,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
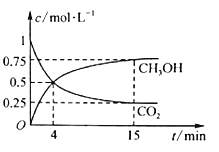
①反应进行到4 min时,v(正)________ (填“>”“<”或“=”)v(逆)。0~4 min,H2的平均反应速率v(H2)= _______。
②下列能说明该反应已达到平衡状态的是_______。
A v正(CH3OH)=3v逆(H2) B CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C 恒温恒压下,气体的体积不再变化 D 恒温恒容下,气体的密度不再变化
③500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
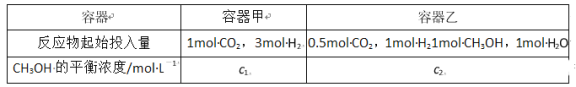
则乙容器中反应起始向_______方向进行;c1_______c2(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将Ⅰ阀关闭,Ⅱ阀打开,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③NaOH溶液 ④饱和碳酸钠溶液 ⑤水

A. ①③ B. ②⑤ C. ②③⑤ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的是
A.c=1 000Vρ/(17V+22 400)B.w=17c/(1000ρ)
C.w=17V/(17V+22 400)D.ρ=(17V+22 400)/(22.4+22.4V)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一。能形成多种化合物,易形成配位化合物。回答下列问题:
(1)Cu位于周期表第四周期第___族。写出其基态原子的电子排布式_____。
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子___.(填“多”“少”或“相等”)。
②第二电离能Cu比Ni高,原因是_____。
(3)Cu可以和EDA( )形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
)形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为_____,O2中σ和![]() 健的个数比是______。
健的个数比是______。
②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是(![]() ,
,![]() ,
,![]() ),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3
),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是
A. 用干燥洁净的玻璃棒蘸取![]() 溶液,点到置于表面皿的pH试纸上测pH
溶液,点到置于表面皿的pH试纸上测pH
B. 氢氧化钠固体或碱石灰既可与浓氨水作用制得氨气,也可用于干燥氨气
C. 双氧水不稳定,见光、遇热、遇大多数金属氧化物都会加快它的分解,但在碱性环境下分解较慢
D. 海带中提取碘的过程中,可用过量的氯气或双氧水氧化水溶液中的![]() ,得到碘单质
,得到碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g) △H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A. 容器I、Ⅲ中平衡常数相同
B. 容器II、Ⅲ中正反应速率相同
C. SO3的体积分数:Ⅱ>III
D. 容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和大于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钾的冶炼可采用如下方法:2KF+CaC2![]() CaF2+2K↑+2C,下列有关说法合理的是( )
CaF2+2K↑+2C,下列有关说法合理的是( )
A.该反应的氧化剂是KF,氧化产物是K
B.该反应能说明C的还原性大于K
C.电解KF溶液不可能制备金属钾
D.CaC2、CaF2均为离子化合物,且阴、阳离子个数比均为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com