
使用氯化钠作原料可以得到多种产品。
(1)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的物质的量浓度是______________(忽略反应前后溶液体积的变化)。
(2)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。

对电源电极名称和消毒液的主要成分判断正确的是________(填字母序号)。
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
(3)实验室中很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。某同学利用上图装置,只更换一个电极,通过电解法制取较纯净的Fe(OH)2沉淀,且较长时间不变色。该同学换上的电解材料是__________(用元素符号表示),总的反应式是___________。
答案 (1)0.1 mol·L-1 (2)B
(3)Fe Fe+2H2O Fe(OH)2↓+H2↑
Fe(OH)2↓+H2↑
解析 (1)n(H2)=n(Cl2)=0.005 mol,参加反应的n(NaCl)=0.01 mol,说明NaCl恰好电解完毕,溶液变为NaOH溶液,n(NaOH)=n(NaCl)=0.01 mol,c(NaOH)=0.1 mol·L-1。
(2)电解饱和氯化钠溶液的总反应:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,题目要求使Cl2被完全吸收,则氯气必须在下部的电极上产生,下部的电极是阳极,推出b为电源的正极,另一极为负极a。生成的Cl2与阴极区产生的NaOH反应:Cl2+2NaOH===NaCl+NaClO+H2O,则消毒液的主要成分是NaClO、NaCl。
2NaOH+H2↑+Cl2↑,题目要求使Cl2被完全吸收,则氯气必须在下部的电极上产生,下部的电极是阳极,推出b为电源的正极,另一极为负极a。生成的Cl2与阴极区产生的NaOH反应:Cl2+2NaOH===NaCl+NaClO+H2O,则消毒液的主要成分是NaClO、NaCl。
(3)题目要求通过电解法制取Fe(OH)2,电解质溶液是NaCl溶液,必须通过电极反应产生Fe2+和OH-。根据电极发生反应的特点,选择铁作阳极,铁发生氧化反应产生Fe2+;溶液中的阳离子Na+、H+向阴极移动,根据放电顺序,阴极H+放电产生氢气,H+来源水的电离,反应式2H2O+2e-===H2↑+2OH-。在电场作用下,阳极产生的Fe2+与阴极产生的OH-在定向移动的过程中相遇,发生复分解反应生成Fe(OH)2沉淀。将阳极反应式、阴极反应式叠加得到总的反应式:Fe+2H2O Fe(OH)2↓+H2↑。
Fe(OH)2↓+H2↑。
题组二 电解原理的“不寻常”应用


科目:高中化学 来源: 题型:
工业上,通过如下转化可制得KClO3晶体:
NaCl溶液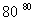 NaClO3溶液
NaClO3溶液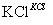 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式:NaCl+H2O===NaClO3+__________。
②Ⅱ中转化的基本反应类型是________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量 121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )
A.920 kJ B.557 kJ
C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。
【实验Ⅰ】 确定硫的质量:
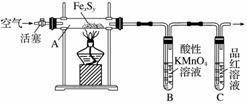
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0 g铁硫簇结构(含有部分不反应的杂质),在试管 B中加入50 mL 0.100 mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后,将B中溶液转移至 250 mL 容量瓶,洗涤试管B后定容。取25.00 mL 该溶液用0.01 mol·L-1的草酸(H2C2O4)溶液滴定剩余的 KMnO4。记录数据如下:
| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
相关反应:①2MnO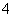 +2H2O+5SO2===2Mn2++5SO
+2H2O+5SO2===2Mn2++5SO +4H+
+4H+
②2MnO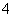 +6H++5H2C2O4===2Mn2++10CO2↑+8H2O
+6H++5H2C2O4===2Mn2++10CO2↑+8H2O
【实验Ⅱ】 确定铁的质量:
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6 g固体。
试回答下列问题:
(1)判断滴定终点的方法是______________________________________________
________________________________________________________________________。
(2)试管C中品红溶液的作用是_____________________________________________。
有同学提出,撤去C装置对实验没有影响,你的看法是________(选填“同意”或“不同意”),理由是___________________________________________________
________________________________________________________________________。
(3)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为________________________________________________________________________。
【问题探究】 滴定过程中,细心的同学发现该KMnO4溶液颜色褪去的速率较平常滴定时要快得多。为研究速率加快的原因,该同学继续进行了下列实验,实验数据如下表:
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
(4)分析上述数据,滴定过程中反应速率加快的一种可能原因是___________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入
0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是( )
A.电解过程中阴极没有气体生成
B.电解过程中转移的电子的物质的量为0.4 mol
C.原CuSO4溶液的浓度为0.1 mol·L-1
D.电解过程中阳极收集到的气体体积为2.24 L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
两个惰性电极插入500 mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解过程中阴极没有H2放出,且电解液在电解前后体积变化可以忽略不计),电极上析出银的质量最大为( )
A.27 mg B.54 mg C.106 mg D.216 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法,正确的是( )


A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置中X和Y均为石墨电极,电解液为500 mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6 g。下列有关说法中不正确的是( )
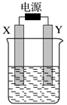
A.X电极是阴极
B.Y电极产生气体的体积为0.28 L
C.电解后溶液的pH=1
D.要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com