
 向500mL某碳酸钠溶液中逐滴加入1mol/L的盐酸,测得溶液中溶液中Cl─、HCO3─的物质的量随加入盐酸体积的关系如图所示,则下列说法中正确的是 ( )
向500mL某碳酸钠溶液中逐滴加入1mol/L的盐酸,测得溶液中溶液中Cl─、HCO3─的物质的量随加入盐酸体积的关系如图所示,则下列说法中正确的是 ( )| A、Oa段与ab段反应的离子方程式均为:CO32-+H+=HCO3- |
| B、该碳酸钠溶液的物质的量浓度为0.5mol/L |
| C、b点时,滴加盐酸的体积为600mL |
| D、b点时生成CO2的物质的量为0.3 mol |
| n |
| c |
| 0.5mol |
| 0.5L |
| 0.6mol |
| 1mol/L |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
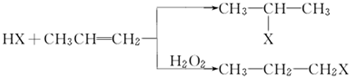
 的物质,该物质是一种香料.
的物质,该物质是一种香料.
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,现以苯酚和乙酸酐(
,现以苯酚和乙酸酐( )为有机原料,合成阿司匹林,请设计完成下列合成途径(合成路线常用的表示方法为:A
)为有机原料,合成阿司匹林,请设计完成下列合成途径(合成路线常用的表示方法为:A| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
| A、在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01 |
| B、室温时,若在NaZ溶液中加水,则c(Z-)/[c(HZ)?c(OH-)]的比值变小,若加少量盐酸,则比值变大 |
| C、等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-) |
| D、在相同温度下,K5>K4>K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
| A、元素的非金属性由弱到强的顺序为:Z<Y<X |
| B、3种元素的最简单氢化物的沸点由高到低的顺序为:X>Z>Y |
| C、3种元素的原子半径由大到小的顺序为:Z>Y>X |
| D、Y元素的最高价氧化物的水化物与其最低价氢化物可以化合成盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 重晶石(主要成分BaSO4)是制取可溶性钡盐的重要原料,工业上可用重晶石、焦炭、空气煅烧可制取BaS,其主要反应的热化学方程式如下:
重晶石(主要成分BaSO4)是制取可溶性钡盐的重要原料,工业上可用重晶石、焦炭、空气煅烧可制取BaS,其主要反应的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||||
B、2NaHCO3
| ||||
C、4NH3+5O2
| ||||
| D、Zn+H2SO4═ZnSO4+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、H+、NO3-、HCO3- |
| B、K+、Al(OH)4-、SO42-、NH3?H2O |
| C、Na+、K+、SO32-、ClO- |
| D、Na+、CH3COO-、SO42-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com