
| A. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| B. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| C. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| D. | 石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
分析 A.明矾水解生成胶体,只能净水不能淡化海水;
B.一般来讲,化学药品着火,可立即用水或泡沫灭火器灭火,但是能够与二氧化碳反应的化学药品着火,如金属钠,不能用水和泡沫灭火器灭火;
C.铜离子为重金属离子,能够使蛋白质变性,所以铁离子有毒,但是铜是人体内一种必需的微量元素,在人体的新陈代谢过程中起着重要的作用;
D.石油催化裂化的主要目的是提高轻质油的产量.
解答 解:A.“海水淡化”即利用海水脱盐生产淡水,明矾可水解生成氢氧化铝胶体,具有吸附性,可除去水中的悬浮物而净化水,但不能使海水淡化,故A错误;
B.可溶性铜盐中含有重金属离子铜离子,重金属离子可以使蛋白质变性,所以说可溶性铜盐有毒;铜与人体健康有着密切的关系,铜是人体健康内一种必需的微量元素,在人体的新陈代谢过程中起着重要的作用,故B正确;
C.钠、过氧化钠都能够与二氧化碳和水反应,所以金属钠着火时不能用水或泡沫灭火器灭火,故D错误;
D.石油裂化的目的是为了提高轻质液体燃料的产量,特别是提高汽油的产量,裂解的目的是为了获得乙烯、丙烯、丁二烯、丁烯、乙炔等,故D错误;
故选B.
点评 本题考查较为综合,涉及海水资源的应用、微量元素在人体的中的作用、化学安全事故及其处理方法、石油裂化裂解等知识,题目难度中等,注意对相关知识的积累,侧重于考查学生对基础知识的应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
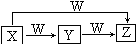 X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )
X、Y、Z、W均为中学化学常见物质,一定条件下它们有如图所示的转化关系(某些产物已略去),下列说法错误的是( )| A. | 若X为HNO3,则W可能为Fe | |
| B. | 若W为O2,X可能是S | |
| C. | 若W为O2,则Z可能为NO | |
| D. | X→Z的离子反应可能为Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③⑤ | C. | ①③⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氟酸在玻璃上镌刻图案:4I++SiO2═H2O+Si4+ | |
| B. | 向Cu2+、Fe3+混合液中加入CuO除去Fe3+;3H2O+3CuO+2Fe3+═2Fe(OH)3+3Cu2+ | |
| C. | 亚硫酸氢钠溶液显酸性:HSO3-═H++SO32- | |
| D. | 用盐酸与碳酸钠反应证明氯的非金属性强与炭:2H++CO32-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸 | |
| B. | 通过改变温度和浓度等条件,利用平衡移动原理制取HCl | |
| C. | 两种强酸混合,溶解度会相互影响,低溶解度的物质析出 | |
| D. | 浓硫酸的浓度(98%)远大于浓盐酸的浓度(37%),高浓度的酸制取低浓度的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
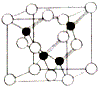 氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.| 物质 | 熔点/℃ | 沸点/℃ | 分解温度/℃ |
| NH3 | 195.3 | 239.7 | 107.3 |
| PH3 | 139.2 | 185.4 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,溶液中水的电离程度:①>② | |
| B. | 向①加水后所得溶液c(CH3COO-)/c(CH3COOH)的比值变大 | |
| C. | 等体积混合溶液①和溶液②,所得溶液中2c(SO42-)=c(Na+) | |
| D. | 25℃时,向溶液②中滴加溶液①至pH=7,溶液中c(Na+)>c(CH3COO-)+c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
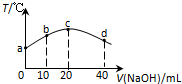 若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-) | |
| C. | c点混合溶液中:c(OH-)>c(HNO2) | |
| D. | d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ④⑥⑧ | C. | ①②④⑤ | D. | ④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com