
下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同 压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年广西省高二上9月月考化学试卷(解析版) 题型:填空题
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
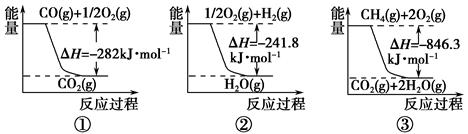
反应①②③均为____________反应(填“吸热”或“放热”)。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。为进一步提高CO2
CO(NH2)2(l)+H2O(g)。为进一步提高CO2
的平衡转化率,下列措施中能达到目的的是____________。
A.增大NH3的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
(3)尿素在农业生产中起重要作用,其合成过程分两步进行:
2NH3(g)+CO2(g) NH2COONH4(l)△H=-117kJ·mol-1
NH2COONH4(l)△H=-117kJ·mol-1
NH2COONH4(l) (NH2)2CO(g)+H2O(g)△H=+15kJ·mol-1
(NH2)2CO(g)+H2O(g)△H=+15kJ·mol-1
①第一步反应在11.1Mpa、160℃的条件下反应较快,转化率也较高,第二步反应在相同条件下反应速率较慢,转化率也较低.因此,总反应的反应速率和转化率主要取决于___________.(填“第一步”或“第二步”)
②对于第一步反应,不能判断该反应一定达到化学平衡状态的依据是__________(填字母).
A.容器中气体的平均相对分子质量不随时间而变化
B.υ(NH3)正=2υ(CO2)逆
C.恒容容器中气体的密度不随时间变化而变化
D.容器中各物质总质量不随时间变化而变化
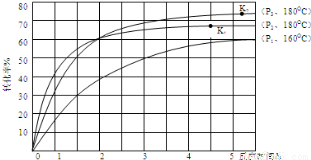
③第一步反应生成了1mol氨基甲酸铵,再发生第二步反应时的转化率与温度、压强的关系如图所示:
在180℃的条件下,P2_________P3(填“>”、“<”或“=”,下同);化学平衡常数K1_________K2.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高一上学期期中化学卷(解析版) 题型:选择题
瓦斯中甲烷与氧气的质量比为1∶4时极易爆炸,此时甲烷与氧气的体积比为
A. 1∶4 B.1∶2 C. 1∶1 D.2∶1
1∶1 D.2∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上学期期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加
B.对于有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大
C.改变条件能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的有效碰撞几率
D.对于本来不能发生的化学反应,改变条件可以使反应发生
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上学期期中化学卷(解析版) 题型:选择题
在298K、100kPa时,已知:
2H2O(g)=O2(g)+2H2(g) △H1
Cl2(g)+H2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3 ,
,
则△H3与△H1和△H2间的关系正确的是
A.△H3=△H1+2△H2 B.△H3=△H1+△H2 C.△H3=△H1-2△H2 D.△H3=△H1-△H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上10月月考化学卷(解析版) 题型:填空题
现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);
⑶将六份溶液同等程度稀释10倍后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”);
⑷某二元酸H2A电离方程式是H2A=H++HA-、HA- A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
①Na2A溶液显__________性,理由是__________(用离子方程式表示).
②若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能__________0.11mol/L(填“<”、“>”或“=”)理由是______________.
③0.1mol/LNaHA溶液中各离子浓度由大到小的顺序是______________.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上10月月考化学卷(解析版) 题型:选择题
下列有关电解质溶液中粒子浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上月考一化学试卷(解析版) 题型:填空题
生物质资源是一种污染小的可再生能源,生物质的主要转化途径及主要产物如图。
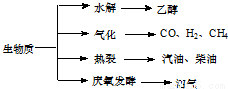
(1)下列有关说法正确的是
A.生物质能,本质上能量来源于太阳能
B.由纤维素水解获得的乙醇属生物质能
C.生物质裂解获得的汽油、柴油等属于纯净物
D.由植物秸秆等发酵获得的沼气,主要成分是甲烷
(2) 由生物质能获得的CO和H2,当两者1: 1催化反应,其原子利用率达100%,合成的物质可能是________。
A.汽油 B.甲醇 C.甲醛(HCHO) D.乙酸
(3) 已知在生物质气化炉中可发生:
C(s)+CO2(g)═2CO(g);△H=+172kJ/mol
CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206kJ/mol
CH4(g)+2H2O(g)═CO2(g)+4H2(g);△H=+165kJ/mol
则C(s)+H2O(g)═CO(g)+H2(g);△H=____________kJ/mol.
(4)由生物质能获得的CO和H2可以用来合成液态燃料甲醇,实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
(5) 己知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西大学附中高一上10月模块诊断化学卷(解析版) 题型:选择题
下列做法正确的是
A.用量筒量取20.21 mL质量分数为98%的浓H2SO4
B.将5.85 g NaCl溶入100mL水中,制得1 mol/LNaCl溶液
C.将22.4 L HCl气体溶于水配成1 L且浓度为1 mol/L的盐酸
D.将1体积c mol/L的硫酸用水稀释为5体积,以获得浓度为0.2c mol/L的 硫酸
硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com