
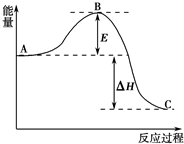
 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 200℃.20MPa |
| 250℃~300℃ |
| c[Fe(CO)5] |
| c(Fe)?c5(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解质与非电解质的本质区别是在水溶液或熔化状态下能否电离 |
| B、盐酸的导电性一定比醋酸的强 |
| C、酸、碱和盐类都属于电解质,其他化合物都是非电解质 |
| D、溶于水能导电的化合物一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷 | B、丙烷 | C、丁烷 | D、戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
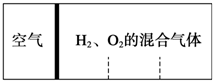 如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的
如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的| 1 |
| 4 |
| A、2:7 | B、5:4 |
| C、2:1 | D、4:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com