
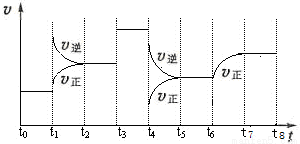
(12 分)T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g) 2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。
2NH3(g) △H=-92.0kJ /mol。t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如下图所示。
试回答下列问题:
(1)T℃时,N2的转化率为:___________,该反应的平衡常数K=___________。
(2)T℃时,下列能证明该反应已经建立平衡状态的是:__________________。
A.体系总压强不再改变
B.混合气体颜色不再改变
C.H2的质量百分含量不再改变
D.c(N2)与c(NH3)的比值不再改变
(3)t1时刻,改变的外界条件是__________,平衡常数K(t5~t6) ______ K(t7~t8)(填“>、<或=”,下同)。
(4)T℃时,建立平衡后,向容器中加入2molN2和2molNH3,则此时 v正 ___ v逆。
(12 分,每空2分)
(1) 50 %; 16(mol?L?1)-2 (2) ACD (3) 升温 ;= (4) >
【解析】
试题分析:(1)根据N2(g)+3H2(g) 2NH3(g),建立平衡后,测得生成NH3的量为2mol,则转化的N2为1mol,所以N2的转化率=1mol÷2mol×100%=50%;平衡时各气体的浓度为c(N2)=1mol÷2L=0.5mol?L?1,c(H2)=(4mol—3mol)÷2L=0.5mol?L?1,c(NH3)=2mol÷2L=1mol?L?1,则平衡常数K=(1mol?L?1)2÷[0.5mol?L?1×(0.5mol?L?1)3]=16(mol?L?1)-2。
2NH3(g),建立平衡后,测得生成NH3的量为2mol,则转化的N2为1mol,所以N2的转化率=1mol÷2mol×100%=50%;平衡时各气体的浓度为c(N2)=1mol÷2L=0.5mol?L?1,c(H2)=(4mol—3mol)÷2L=0.5mol?L?1,c(NH3)=2mol÷2L=1mol?L?1,则平衡常数K=(1mol?L?1)2÷[0.5mol?L?1×(0.5mol?L?1)3]=16(mol?L?1)-2。
(2)A、该反应前后气体的系数不相等,所以体系总压强不再改变,反应达到平衡;B、反应体系中各气体均为无色,所以混合气体颜色不再改变不能说明建立平衡;C、H2的质量百分含量不再改变,说明反应已达到平衡;D、c(N2)与c(NH3)的比值不再改变,说明c(N2)与c(NH3)不变,反应已达到平衡。
(3)t1时刻,正、逆反应速率都增大,逆反应速率更大,平衡向逆反应方向移动,该反应为放热反应,所以改变的条件是升温;t6正反应速率在原来的基础上逐渐增大,则改变的条件不是温度,所以平衡常数不变,所以K(t5~t6) = K(t7~t8)。
(4)向容器中加入2molN2和2molNH3,c(N2)=(1mol+2mol)÷2L=1.5mol?L?1,c(NH3)=(2mol+2mol)÷2L=2mol?L?1,则浓度积=(2mol?L?1)2÷[1.5mol?L?1×(0.5mol?L?1)3]=21.3(mol?L?1)-2 > K,平衡向正反应方向移动,所以v正 > v逆。
考点:本题考查转化率的计算、化学平衡常数的计算及计算、化学平衡状态的判断、化学平衡移动。


科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:简答题
(14分)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
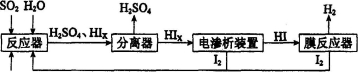
回答下列问题:
(1)在反应器中发生反应的化学方程式是______________。
(2)在膜反应器中发生反应:2HI(g)  H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
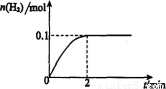
①该温度下,反应平衡常数K=_______,若升高温度,K值将_______
(填“增大”、“减小”或“不变?’)。
②用化学平衡原理解释使用膜反应器及时分离出H2的目的是___________________
(3)电渗析装置如下图所示:
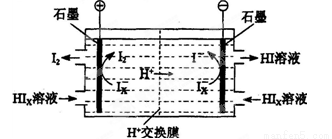
①结合电极反应式解释阴极区HIx转化为HI的原理是______________________________
②该装置中发生的总反应的化学方程式是________________________
(4)上述工艺流程中循环利用的物质是_________。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.1mol Cl2通入含有2mol FeI2的溶液中:2Fe2++2I﹣+2Cl2=2Fe3++4Cl﹣+I2
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O
C. AlCl3溶液中加入过量氨水:Al3++4OH﹣=AlO2﹣+2H2O
D.向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH﹣+3H+=Ag++2NH4++H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:填空题
(15分)下表是元素周期表的一部分,请参照①~⑥在表中的位置,用化学用语回答下列问题:
| I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 |
|
| ① | ② | ③ | ④ |
|
|
3 |
|
|
|
| ⑤ |
| ⑥ |
|
(1) ⑥有两种同位素,其中一种原子核内有18个中子,其原子符号为_______;
(2)②与④可以形成一种温室气体,其电子式为_______;
(3) ③和⑤的氢化物沸点 __________(填分子式)高,原因是______________;
(4)②和⑥按原子个数比为1:4形成的化合物为_______分子(填极性或非极性),含有_______键(填极性或非极性)
(5) ②形成的单质可以是不同类型的晶体,它们可能是____________(填字母)
A原子晶体 B分子晶体 C金属晶体 D离子晶体 E.混合型晶体
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:选择题
下列物质分类正确的是
A.苯和溴苯均为芳香烃 B.酚醛树脂和聚乙烯均为体型高分子材料
C.葡萄糖和麦芽糖均为还原性糖 D.油脂和淀粉均为天然高分子化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+ 2Pb2+(aq)+ H2O(l) 2PbCrO4(s)+ 2H+(aq)△H<0
2PbCrO4(s)+ 2H+(aq)△H<0
该反应达平衡后,改变条件,下列说法正确的是
A.移走部分PbCrO4固体,Cr2O72-转化率升高
B.升高温度,该反应的平衡常数(K)增大
C.加入少量NaOH固体,自然沉降后,溶液颜色变浅
D.加入少量K2Cr2O7固体后,溶液中c(H+)不变
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
下列排列顺序正确的是
A.熔点:MgBr2> Cs > Na
B.微粒半径:Ca2+ > C1- > Mg2+
C.碱性:KOH > Mg(OH)2 > Al(OH)3
D.氧化性:Cu2+ > Fe3+ > K+
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
下列实验步骤与实验事实的相应结论解释正确的是
选项 | 实验步骤与实验事实 | 结论解释 |
A | Mg(OH)2、Al(OH)3混合物中加入NaOH溶液,Al(OH)3溶解而Mg(OH)2没有溶解 | Mg(OH)2Ksp比Al(OH)3的小 |
B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuS的Ksp比ZnS的小 |
C | 在溶有NH3的BaCl2溶液中通入CO2,有白色沉淀生成 | NH3在反应中作催化剂 |
D | 单质硅不溶于浓硫酸和浓硝酸 | 硅被强氧化性酸钝化 |
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。
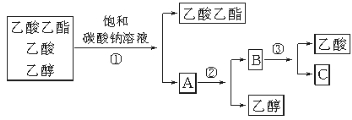
在上述实验过程中,所涉及的三次分离操作分别是
A.①蒸馏、②过滤、③分液 B.①分液、②蒸馏、③蒸馏
C.①蒸馏、②分液、③分液 D.①分液、②蒸馏、③结晶、过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com