
下列物质在固态时是原子晶体的是( )
A.二氧化硅 B.硝酸铵
C.磷酸 D.蔗糖
科目:高中化学 来源:福建省师大附中2011-2012学年高二下学期期中考试化学试题 题型:022
(1)高纯铜(纯度可达99.99%)广泛应用于电器工业.某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜.请在下图中标明电极材料和电解质溶液的名称
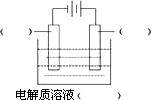
已知Ni的金属活动性介于Fe和Sn之间.则精炼完成后,在阳极底部的沉积物中可回收到的金属为________(填化学式).
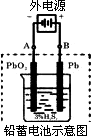
(2)若在实验室中完成此实验,可用铅蓄电池做电源.铅蓄电池的电池总反应式为:
2PbSO4+2H2O在完全放电耗尽PbO2和Pb时,若按下图所示连接进行充电,充电一段时间后,则在A电极上生成________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(3)在如图用石墨作电极的电解池中,放入500 mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重0.16 g.请回答下列问题:

①B电极的反应式________.
②原溶液的物质的量浓度是________;电解后溶液的pH为________.(假设电解前后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)
(1)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。
请在如图中标明电极材料和电解质溶液的名称
已知Ni的金属活动性介于Fe和Sn之间。则精炼完成后,在阳极底部的沉积物中可回收到的金属为 ________(填化学式)。
(2)若在实验室中完成此实验,可用铅蓄电池做电源。铅蓄电池的电池总反应式为:
2PbSO4+2H2O Pb+PbO2+4H++2SO42-
在完全放电耗尽PbO2和Pb时,若按上图所示连接进行充电,充电一段时间后,则在A电极上生成__________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(3)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重0.16 g 。请回答下列问题:
①B电极的反应式_____________________。
②原溶液的物质的量浓度是_________________;电解后溶液的pH为 ________。(假设电解前后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建师大附中高二下学期期中考试化学试卷(带解析) 题型:填空题
(10分)
(1)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。
请在如图中标明电极材料和电解质溶液的名称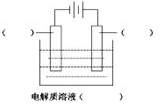
已知Ni的金属活动性介于Fe和Sn之间。则精炼完成后,在阳极底部的沉积物中可回收到的金属为 ________(填化学式)。
(2)若在实验室中完成此实验,可用铅蓄电池做电源。铅蓄电池的电池总反应式为:
2PbSO4+2H2O  Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42-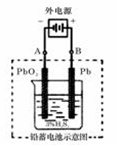
在完全放电耗尽PbO2和Pb时,若按上图所示连接进行充电,充电一段时间后,则在A电极上生成__________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(3)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重0.16 g。请回答下列问题: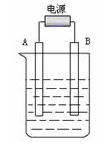
①B电极的反应式_____________________。
②原溶液的物质的量浓度是_________________;电解后溶液的pH为 ________。(假设电解前后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源:2014届山西省晋中市高二下学期期末考试化学试卷(解析版) 题型:填空题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的最高价氧化物对应的水化物化学式为H2XO3 |
|
Y |
Y是地壳中含量最高的元素 |
|
Z |
Z的基态原子最外层电子排布式为3s23p1 |
|
W |
W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25°、101kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
(5)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下: 2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
①反应物A的化学式为 ,属于 晶体
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如下图所示, 位于大立方体顶点和面心,
位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是
(填具体的微粒符号)
位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是
(填具体的微粒符号)

查看答案和解析>>
科目:高中化学 来源:2013届福建师大附中高二下学期期中考试化学试卷(解析版) 题型:填空题
(10分)
(1)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。
请在如图中标明电极材料和电解质溶液的名称
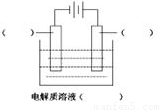
已知Ni的金属活动性介于Fe和Sn之间。则精炼完成后,在阳极底部的沉积物中可回收到的金属为 ________(填化学式)。
(2)若在实验室中完成此实验,可用铅蓄电池做电源。铅蓄电池的电池总反应式为:
2PbSO4+2H2O  Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42-

在完全放电耗尽PbO2和Pb时,若按上图所示连接进行充电,充电一段时间后,则在A电极上生成__________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(3)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重0.16 g 。请回答下列问题:
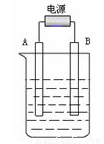
①B电极的反应式_____________________。
②原溶液的物质的量浓度是_________________;电解后溶液的pH为 ________。(假设电解前后溶液的体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com