
【题目】某工厂冶炼钛精矿得到钛渣,钛渣的成分及含量(质量分数)为:TiO251.00%、Al2O319.34%、MgO7.20%、CaO4.00%、SiO218.46%,通过下列工艺流程可以得到纳米二氧化钛和某型分子筛(化学式为Na4Al4Si4O16 9H2O)。
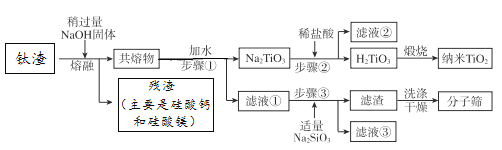
下列说法不正确的是
A. 钛渣中的TiO2、SiO2不属于碱性氧化物
B. 滤液①中溶质只有NaAlO2、NaOH
C. 步骤②中加入盐酸时,反应的离子方程式是Na2TiO3 + 2H+![]() H2TiO3↓+2Na+
H2TiO3↓+2Na+
D. 步骤③中加入适量Na2SiO3时,反应的化学方程式为:4NaAlO2 + 4Na2SiO3 +13H2O ![]() Na4Al4Si4O16 9H2O↓ + 8NaOH
Na4Al4Si4O16 9H2O↓ + 8NaOH
【答案】B
【解析】
A. 钛渣中的TiO2属于两性氧化物,SiO2属于酸性氧化物,均不属于碱性氧化物,选项A正确;
B. 钛渣在稍过量的氢氧化钠中共熔后得到的残渣主要为硅酸钙和硅酸镁,根据各成分的质量分数可知,二氧化硅过量,共熔物加水过滤后得到Na2TiO3和滤液,则滤液①中溶质有NaAlO2、NaOH、Na2SiO3,选项B不正确;
C. 步骤②中加入盐酸时Na2TiO3与盐酸反应生成H2TiO3和氯化钠,反应的离子方程式是Na2TiO3 + 2H+=H2TiO3↓+2Na+,选项C正确;
D. 步骤③中加入适量Na2SiO3时偏铝酸钠和硅酸钠反应生成Na4Al4Si4O16 9H2O和氢氧化钠,反应的化学方程式为:4NaAlO2 + 4Na2SiO3 +13H2O =Na4Al4Si4O16 9H2O↓ + 8NaOH,选项D正确。答案选B。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】下列分离方法不合理的是( )
A.用分馏的方法,可从石油中得到汽油
B.提取溴水中的溴,可用加入乙醇萃取的方法
C.只含有泥沙的粗盐,可通过溶解、过滤、结晶的方法提纯
D.除FeCl2溶液中的少量FeCl3,可用加入足量铁屑过滤的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 核素![]() H的中子数是0 B. 12C和14C互为同位素
H的中子数是0 B. 12C和14C互为同位素
C. 金刚石、石墨和富勒烯互为同素异形体 D. CH3CH2OH和CH3OCH3互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌蓄电池应用广泛,放电时总反应为Zn+Ag2O2+H2O==Zn(OH)2+Ag2O,某小组以银锌蓄电池为电源,用惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,设计如图所示装置。连通电路后,下列说法正确是
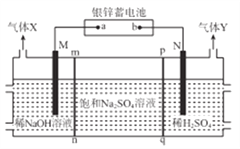
A. 电池的a极反应式为Ag2O2+H2O+2e-=Ag2O+2OH-
B. 气体Y为H2
C. pq膜适宜选择阳离子交换膜
D. 电池中消耗65gZn,理论上生成1mol气体X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FePO4是一种难溶于水的白色固体,可用金属防腐剂,也可用于制备电动汽车电池的正极材料LiFePO4。实验室利用FeSO47H2O和H3PO4(弱酸)制备FePO4 、LiFePO4流程如下图:
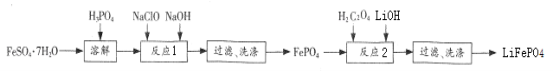
回答下列问题:
(1)“溶解”时H3PO4不宜过量太多的原因是__________。
(2)①洗涤FePO4沉淀的操作是__________;
②若经多次洗涤后所得“FePO4”仍呈棕色,则“FePO4”最可能混有的杂质是_____。
(3)“反应1”时总反应的离子方程式是_____________。
(4)“反应2”时总反应的化学方程式是:2LiOH + 6H2C2O4 + 2FePO4![]() 2LiFePO4 + 7CO2 + 5X +7H2O ,其中X的化学式为____;每生成1molLiFePO4,该反应转移_______mole-。
2LiFePO4 + 7CO2 + 5X +7H2O ,其中X的化学式为____;每生成1molLiFePO4,该反应转移_______mole-。
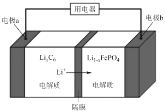
(5)LiFePO4电池稳定性高、安全、对环境友好,该电池的总反应式是:LiFePO4 + C6 ![]() Li1﹣xFePO4 + LixC6,其放电时工作原理如图所示。
Li1﹣xFePO4 + LixC6,其放电时工作原理如图所示。
则:充电时,a极的电极反应式为_____________;
放电时,b极的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数为98℅、密度为1.84g/mL的浓硫酸来配制480mL 0.2mol/L 的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。完成下列问题:
(1)上述仪器中,在配制稀硫酸时不需要用到的是___________(填序号)
(2)配制过程中需选用的容量瓶规格为___________ mL,经过计算,需要浓硫酸的体积为_______。
(3)在配制过程中,下列操作错误的是____________,能使所配溶液浓度偏高的是___________(填序号)
①洗涤量取浓硫酸后的量筒,并将洗涤液转移至容量瓶中
②为防止变质,稀释后的硫酸溶液应立即就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④移液前,容量瓶中含有少量蒸馏水
⑤量取浓硫酸时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种重要化工原料,难溶于水,在潮湿空气中易水解氧化。回答下列问题:
(1)CuCl的保存方法是_______。
(2)CuCl在含一定浓度Cl-溶液中会部分溶解,存在如下平衡:2CuCl(s)![]() Cu++CuCl2- ΔH<0。溶液中c(Cu+)和c(CuCl2-)的关系如图。
Cu++CuCl2- ΔH<0。溶液中c(Cu+)和c(CuCl2-)的关系如图。
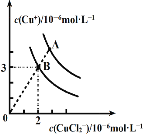
①上述反应在B点的平衡常数K=_____。
②使图中的A点变为B点的措施可以是_____。
(3)利用CuCl难溶于水的性质,可以除去水溶液中的Cl-。
①除Cl-的方法是向含Cl-的溶液同时加入Cu和CuSO4。反应的离子方程式为________。
②已知:Cu+Cu2+![]() 2Cu+ K1=7.6×10-7;Ksp(CuCl)=2.0×10-6。通过计算说明上述除Cl-的反应能完全进行的原因。_____
2Cu+ K1=7.6×10-7;Ksp(CuCl)=2.0×10-6。通过计算说明上述除Cl-的反应能完全进行的原因。_____
③若用Zn替换Cu可加快除Cl-速率,但需控制溶液的pH。若pH过低,除Cl-效果下降的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是
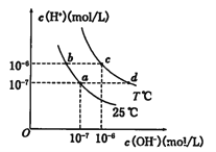
A. 向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-)
B. 25℃时,加入CH3COONa可能引起由c向d的变化,升温可能引起a向c的变化
C. T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D. b点对应的溶液中大量存在:K+、Ba2+、NO3-、I-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com