
【题目】硝苯地平是抗心绞痛药,也可用于降血压,其合成路线如下。
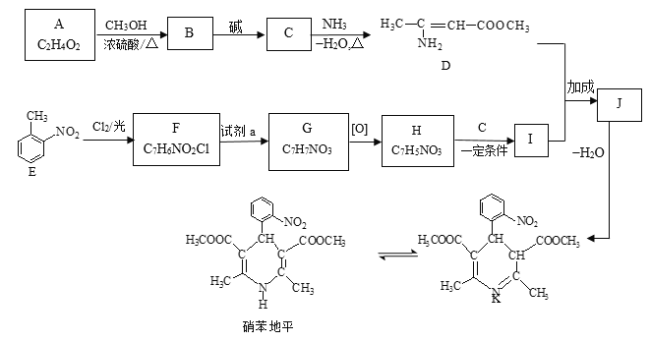
已知: Ⅰ. RCOOR1+![]()
![]()
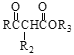 +R1OH
+R1OH
Ⅱ. R1CHO+![]()
![]()
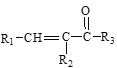
Ⅲ.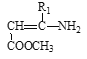 +
+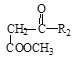
![]()
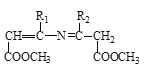
![]()
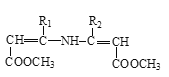
请回答下列问题:
(1)A属于羧酸,写出A的电离方程式________。
(2)A→B的反应类型为________。
(3)D的官能团名称为________。
(4)写出B→C的方程式________。
(5)F→G所需的试剂a是________。
(6)聚合物L的单体是E的同分异构体,其单体结构同时满足以下条件,写出L的结构简式:________。
a. 具有两性 b. 苯环上的一氯代物共有两种
(7)写出结构简式:I________ 、J________。
【答案】CH3COOH![]() CH3COO-+H+ 取代(酯化) 氨基、碳碳双键、酯基 2CH3COOCH3
CH3COO-+H+ 取代(酯化) 氨基、碳碳双键、酯基 2CH3COOCH3![]() CH3COCH2COOCH3+CH3OH NaOH溶液和H2O(或NaOH水溶液)
CH3COCH2COOCH3+CH3OH NaOH溶液和H2O(或NaOH水溶液) ![]()
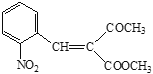
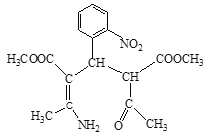
【解析】
A分子式是C2H4O2,属于一元羧酸,则A是CH3COOH,A与CH3OH在浓硫酸存在时、加热条件下反应产生的B是CH3COOCH3,根据已知I,B在碱存在反应生成C和CH3OH,C为CH3COCH2COOCH3,C与NH3发生反应生成的D是![]() ;结合F的分子式,E与Cl2在光照条件下发生甲基上的取代反应生成的F为
;结合F的分子式,E与Cl2在光照条件下发生甲基上的取代反应生成的F为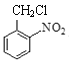 ,结合G的分子式,F与NaOH的水溶液共热,发生取代反应生成的G为
,结合G的分子式,F与NaOH的水溶液共热,发生取代反应生成的G为 ,G发生催化氧化产生H:
,G发生催化氧化产生H: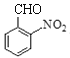 ,H与C在一定条件下发生已知II的反应生成I,I的结构简式为
,H与C在一定条件下发生已知II的反应生成I,I的结构简式为 ,I与D发生加成反应生成J,J发生已知III的反应最终得到硝苯地平,根据硝苯地平的结构简式可知,J的结构简式为
,I与D发生加成反应生成J,J发生已知III的反应最终得到硝苯地平,根据硝苯地平的结构简式可知,J的结构简式为 。
。
(1) A分子式是C2H4O2,属于羧酸,则A是乙酸,结构简式为CH3COOH;乙酸是一元弱酸,在溶液中存在电离平衡,电离方程式为:CH3COOH![]() CH3COO-+H+。
CH3COO-+H+。
(2)乙酸与甲醇在浓硫酸存在的条件下发生酯化反应产生乙酸甲酯CH3COOCH3和水,酯化反应也是一种取代反应,所以A→B的反应类型为酯化反应(或取代反应)。
(3)D结构简式为![]() ,分子中含有的官能团名称为氨基、碳碳双键、酯基。
,分子中含有的官能团名称为氨基、碳碳双键、酯基。
(4)B为CH3COOCH3,C为CH3COCH2COOCH3,B→C的化学方程式为:2CH3COOCH3![]() CH3COCH2COOCH3+CH3OH。
CH3COCH2COOCH3+CH3OH。
(5)F是 ,F与NaOH的水溶液共热,发生取代反应产生G:
,F与NaOH的水溶液共热,发生取代反应产生G: ,所以F→G所需的试剂a是NaOH的水溶液。
,所以F→G所需的试剂a是NaOH的水溶液。
(6)E是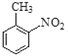 ,分子式是C7H7O2N,聚合物L的单体是E的同分异构体,其单体结构同时满足以下条件:a.具有两性,说明含有-COOH和-NH2; b. 苯环上的一氯代物共有两种,说明在苯环对位上的有两个取代基,则L单体的结构简式为
,分子式是C7H7O2N,聚合物L的单体是E的同分异构体,其单体结构同时满足以下条件:a.具有两性,说明含有-COOH和-NH2; b. 苯环上的一氯代物共有两种,说明在苯环对位上的有两个取代基,则L单体的结构简式为![]() ,该物质发生缩聚反应产生L,则聚合物L的结构简式为
,该物质发生缩聚反应产生L,则聚合物L的结构简式为![]() ;
;
(7)根据上述分析可知I结构简式: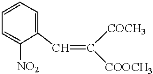 ;J结构简式为
;J结构简式为 。
。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
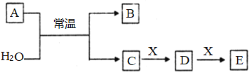
(1)若A为常见的金属单质,且其焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___________________________________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为__________(填字母)。
a. NaHCO3 b. Na2CO3 c.Al(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为_______ 。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为___。(填字母)
a.盐酸 b.CaCl2溶液 c.氨水 d.澄清石灰水
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与水反应的化学方程式中氧化剂与还原剂的物质的量之比为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已如反应:CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g) +HCl(g)。在一定压强下,按ω=
CH2=CHCH2Cl(g) +HCl(g)。在一定压强下,按ω=![]() 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ) 与温度(T)、ω 的关系,图乙表示逆反应的平衡常数与温度的关系。则下列说法错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ) 与温度(T)、ω 的关系,图乙表示逆反应的平衡常数与温度的关系。则下列说法错误的是

A. 图甲中,ω2>1
B. 图乙中,A线表示逆反应的平衡常数
C. 温度T1、ω=2时,Cl2的转化率为50%
D. 若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
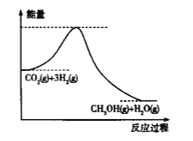
【题目】缓解当前能源和资源紧张问题的方法无非是开源和节流两个方面,从开源角度看,有效地开发利用燃煤产生的CO2重新合成新的燃料是一个途径,目前工业上用CO2来生产甲醇的原理是CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
(1)上述反应过程中的能量变化如图所示,该反应是_____________(填“吸热”或“放热”)反应。
(2)一定温度下,将5molCO2和8molH2充入2L恒容密闭容器中发生上述反应,测得H2的物质的量与时间的关系如图所示,
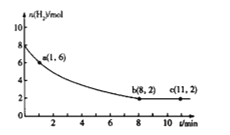
0-1min内,用CO2表示的平均反应速率v(CO2)=________________(保留两位有效数字);a点的逆反应速率________________b点的逆反应速率(填“>”“<”或“=”)。
(3)对于在恒温恒容条件下进行的反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下列叙述不能说明其已达到平衡状态的是________________(填序号)。
CH3OH(g)+H2O(g),下列叙述不能说明其已达到平衡状态的是________________(填序号)。
a. 混合气体的密度不再改变
b. 容器内的压强不再发生变化
c. CH3OH(g)的浓度保持不变
d. 单位时间内消耗1molCO2,同时生成1molCH3OH
(4)甲醇燃料电池是一种高效、环境友好的发电装置,结构如图所示(电解质溶液为稀硫酸):

①Pt(b)电极上发生_____________(填“氧化”或“还原”)反应,电极反应式为________________________。
②如果该电池工作时导线中通过3mol电子,则理论上消耗甲醇的物质的量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W在周期表中的相对位置如图所示,其中X、Y、W的最外层电子数之和为15,Z和X的最外层电子数相差2,下列说法正确的是
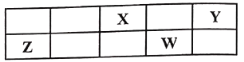
A.原子半径:r(Z)>r(W)>r(Y)>r(X)B.X的氢化物的沸点一定比Y的氢化物的沸点低
C.一定条件下,Z可以置换出XD.X、Y元素的单质均只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把二氧化硫通入硝酸铁溶液中,溶液由黄色变为浅绿色,但立即又变为黄色,此时若滴入氯化钡溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是( )
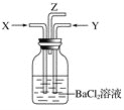
A.SO2B.NO3-C.Fe3+D.Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压条件下,1 mol M气体和1 mol N气体在密闭容器中发生反应: M(g) +3N(g)2Q(g)。下列说法可以判定反应达到平衡状态的是
A.![]() 正(M)=2
正(M)=2![]() 逆(Q)B.c(N):c(Q)=3:2
逆(Q)B.c(N):c(Q)=3:2
C.M的体积分数不再发生变化D.混合气体的密度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用CO和H2合成再生能源甲醇,反应为:2H2(g)+CO(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)一定温度下,将1molCO与1molH2通入VL恒容密闭容器中发生反应。
①该反应能自发进行的条件是______(填“高温”、“低温”或“任意温度”)
②下列说法正确的是______。
A.v正(H2)=2v逆(CO)时,反应达到化学平衡状态
B.达到平衡时CO与H2的转化率相等
C.恒温恒压,往原料气中通入少量稀有气体,CO的转化率会降低
D.该反应的正反应活化能大于逆反应活化能
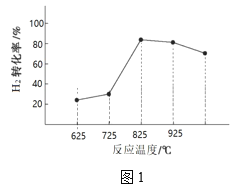
③图1为温度对H2合成甲醇反应的影响,请从反应速率和平衡的角度分析725℃以后H2百分含量随时间增长呈现该变化趋势的原因______。
(2)在恒温T、恒压P的条件下,将3.0molCO与4.5molH2通入容积可变的密闭容器中。达平衡时容器的体积为2L,CO的转化率为50%。
①此反应的正、逆反应速率与浓度的关系为v正=k正c(CO)·c2(H2),v逆=k逆c(CH3OH),其中k正、k逆为速率常数。在温度T下k正、k逆的关系式为k正=_____k逆。
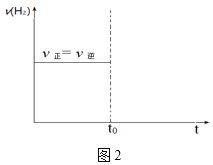
②若平衡时,在t0时刻再向容器中通入9.0molCO,在图2中画出充入CO后的v正、v逆随时间变化的图像_____。
(3)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,请写出生成甲醇的电极反应式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com