
【题目】氮的氧化物是大气污染物,可以通过以下方法处理:
I.催化还原法:在汽车排气管上安装一个催化转化器,发生反应:
2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) △H1
N2(g) + 2CO2(g) △H1
(1)已知:①N2(g) +O2(g)![]() 2NO(g) △H2=+180kJ/mol
2NO(g) △H2=+180kJ/mol
②CO与O2 反应相关的化学键键能数据如下:
化学键 | O=O | C=O | C≡O |
键能/(kJ/mol) | 497 | 803 | 1072 |
则△H1=__________。
(2)在一定温度下,向容积为1L的密闭容器中充入2 molNO、1molCO,10min时反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图1所示:
N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图1所示:
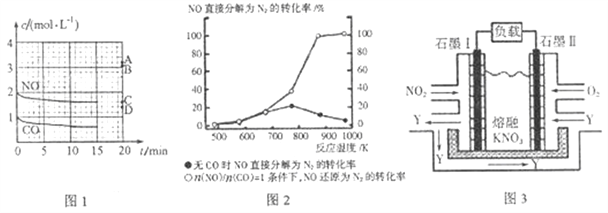
①该反应的平衡常数K=______(结果保留3位有效数字);前10min内用氮气表示的平均反应速率为______。
②若保持其他条件不变,15min时再向该容器中充入少量N2,则此时反应的v正______ v逆(填“>”、“=”或“<”),原因是____________。
③若保持其他条件不变,15min时压缩容器的容积至0.5L,20min时反应重新达到平衡,则此时NO的浓度对应的点应是图1中的______(填字母)。
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2 所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因是______。
II.利用电化学原理,将NO2、O2 和熔融KNO3制成燃料电池,其原理如图3。
(3)该电池在工作过程中NO2转变成绿色硝化剂Y,Y 是一种氧化物,可循环使用,石墨I附近发生的电极反应式为______。相同条件下,消耗的O2 和NO2 的体积比为______。
【答案】 -751kJ/mol 0.0347 0.02mol/(L·min) < 生成物浓度增大,平衡逆向移动 B NO的分解反应为放热反应,升高温度有利于反应逆向进行 NO2-e-+NO3-=N2O5 1:4
【解析】(1)将上面两个热化学方程式相加可得:2CO(g)+O2(g)=2CO2(g) △H=△H1+ △H2,根据反应的焓变等于反应物的总键能减去生成物的总键能有△H1+180 kJ/mol
=(497+1072×2-4×803)kJ/mol,所以△H1=-751 kJ/mol。
(2) ①由图象1可知,平衡时CO物质的量浓度为0.6mol/L,所以CO的物质的量浓度减少0.4mol/L,则平衡时NO的物质的量浓度为2mol/L-0.4mol/L=1.6mol/L,N2和CO2的物质的量浓度分别为0.2mol/L和0.4mol/L,所以K=![]() =0.0347;v(N2)=0.2mol/L÷10min=0.02mol/(L·min)
=0.0347;v(N2)=0.2mol/L÷10min=0.02mol/(L·min)
②15min时反应已达平衡,再向该容器中充入少量N2,生成物的浓度增大,逆反应速增大,正反应速率不变,平衡逆向移动,故v正<v逆,答案为:<、 生成物浓度增大,平衡逆向移动。
③ 其他条件不变,15min时压缩容器的容积至0.5L,若平衡不移动,NO的物质的量浓度变为 3.2 mol/L,但增大压强平衡将正向移动,故NO的物质的量浓度小于3.2mol/L,用极值法考虑,若CO全部反应完则剩余的NO的物质的量为1mol,物质的量浓度为2mol/L,所以达到新平衡时NO的物质的量浓度处于2mol/L到3.2mol/L之间,故对应的点应是图1中的B点。
④由已知信息N2(g)+O2(g)![]() 2NO(g) △H2=+180kJ/mol,可知NO的分解反应是放热反应: 2NO(g)
2NO(g) △H2=+180kJ/mol,可知NO的分解反应是放热反应: 2NO(g)![]() N2(g)+O2(g) △H2=-180kJ/mol,温度升高,平衡逆向进行,NO的转化率降低。
N2(g)+O2(g) △H2=-180kJ/mol,温度升高,平衡逆向进行,NO的转化率降低。
(3)燃料NO2所在电极石墨I为负极,失去电子,Y是氧化物可循环使用,可知Y是N2O5,故石墨I附近发生的电极反应式为:NO2-e-+NO3-=N2O5;负极NO2失去电子生成N2O5,N元素的化合价升高1,正极O2得到电子,O元素的化合价降低4,根据得失电子守恒可知相同条件下,消耗的O2和NO2的体积比为1:4。


科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2=2Ag2S+2H2O,其中H2S是( )
A.氧化剂
B.还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述中,正确的是( )
A. 非金属元素组成的化合物中只含共价键
B. 不同元素的原子构成的分子只含极性共价键
C. 熔融状态下能够导电的化合物中存在离子键
D. 单质分子中均存在化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子价电子构型3d54s2,其在周期表中的位置是( )
A. 第四周期ⅦA族 B. 第四周期ⅡB族
C. 第四周期ⅤB族 D. 第四周期ⅦB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示,下列说法正确的是( ) 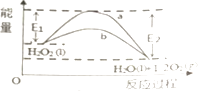
A.有MnO2条件下的反应曲线是a曲线
B.a曲线变为b曲线,反应的活化分子百分数增大
C.a曲线变为b曲线,平衡时H2O2的转化率增大
D.b曲线的热化学方程式为:H2O2(l)═H2O(l)+ ![]() O2(g)△H=﹣(E1﹣E2)KJmol﹣1
O2(g)△H=﹣(E1﹣E2)KJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍。下列有关说法不正确的是
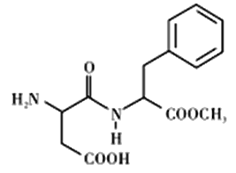
A. 阿斯巴甜在一定条件下既能与酸反应、又能与碱反应
B. 分子式为C14H18N2O3,阿斯巴甜属于蛋白质
C. 1mol阿斯巴甜分子可消耗3molNaOH
D. 一定条件下阿斯巴甜的水解产物中有两种氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将溶液 的c(H+)、c(OH﹣)之比取为AG[AG=lg ![]() ].25℃时,用0.01mol.L﹣1的氢氧化钠溶液滴定20mL相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
].25℃时,用0.01mol.L﹣1的氢氧化钠溶液滴定20mL相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( ) 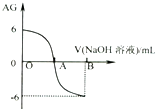
A.A点时c(CH3COO﹣)>c(Na+)
B.室温时0.01mol.L﹣1的醋酸溶液pH=6
C.OA段溶液中均有:c(CH3COO﹣)>c(CH3COOH)
D.若B点时加入NaOH溶液40mL,所得溶液中:c(CH3COO﹣)+2c(CH3COOH)=c(OH﹣)﹣c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com