
| A. | 与H2化合时X单质比Y单质容易 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 在氧化还原反应中,甲失的电子比乙多 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
分析 比较非金属元素的非金属性强弱,可根据单质之间的置换反应、与氢气化合的难易程度、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断.
解答 解:A.元素的非金属性越强,对应单质的氧化性越强,与H2化合越容易,与H2化合时X单质比Y单质容易,元素的非金属性X大于Y,故A正确;
B.元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强,可说明X的非金属性比Y强,故B正确;
C.X原子的最外层电子数比Y原子的最外层电子数多,X的非金属性不一定比Y强,如I最外层7个电子,O最外层6个电子,但是O的非金属性比I强,故C错误;
D.元素的非金属性越强,对应单质的氧化性越强,X单质可以把Y从其氢化物中置换出来,说明X单质的氧化性大于Y单质,元素的非金属性X大于Y,故D正确;
故选C.
点评 本题考查非金属性的判断,题目难度不大,注意非金属性的递变规律以及比较非金属性的角度.


科目:高中化学 来源: 题型:选择题
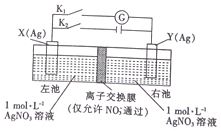
| A. | 闭合K2,断开Kl一段时间后,X电极质量增加 | |
| B. | 闭合K2,断开Kl一段时间后,右池c(AgNO3)增大 | |
| C. | 断开K2,闭合K1,X 电极发生氧化反应 | |
| D. | 断开K2,闭合K1,NO3-从左池向右池移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属单质M能从N的化合物中置换出非金属单质N | |
| B. | 在反应中M原子比N原子得到更多电子 | |
| C. | M的气态氢化物稳定性比N弱 | |
| D. | M的氧化物对应水化物的酸性比N强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
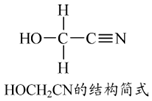 锌是人体必需的微量元素,明朝(天工开物)中有世界上最早的关于炼锌技术的记载.回答下列问题:
锌是人体必需的微量元素,明朝(天工开物)中有世界上最早的关于炼锌技术的记载.回答下列问题: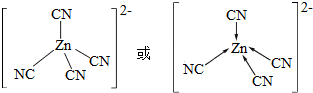 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
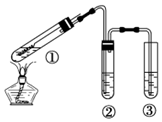
| A. | ②中选用品红溶液验证SO2的生成 | |
| B. | ③中选用NaOH溶液吸收多余的SO2 | |
| C. | 为确认有CuSO4生成,向①中加水,观察颜色 | |
| D. | 上下移动①中铜丝可控制SO2的产生与停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验式 CH2 | B. | 结构简式 CH2=CHCH3 | ||
| C. | 球棍模型: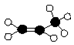 | D. | 加聚反应后的结构简式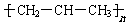 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com