
分析 (1)二氧化氮与水反应生成硝酸与NO;
根据转移电子、结合N元素化合价变化计算消耗的NO2的物质的量,再根据V=nVm计算消耗NO2的体积;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
根据盖斯定律,(①-②)÷2可得:NO2(g)+SO2(g)?SO3(g)+NO(g),焓变也进行相应计算;
可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
令NO2、SO2起始物质的量分别为1mol、2mol,转化的NO2为xmol,则:
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始量(mol):1 2 0 0
变化量(mol):x x x x
平衡量(mol):1-x 2-x x x
平衡时NO2与SO2体积比为1:6,则(1-x):(2-x)=1:6,解得x=0.8,反应气体气体体积不变,用物质的量代替浓度代入K=$\frac{c(S{O}_{3})×c(NO)}{c(N{O}_{2})×c(S{O}_{2})}$计算平衡常数.
解答 解:(1)二氧化氮与水反应生成硝酸与NO,反应方程式为:3NO2+H2O=NO+2HNO3;
当转移1.2mol电子时,消耗的NO2物质的量为$\frac{1.2mol}{4}$=0.3mol,消耗NO2的体积为0.3mol×22.4L/mol=6.72L,
故答案为:3NO2+H2O=NO+2HNO3;6.72;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
根据盖斯定律,(①-②)÷2可得:NO2(g)+SO2(g)?SO3(g)+NO(g),则△H=[-196.6kJ•mol-1-(-113.0kJ•mol-1)]÷2=-41.8kJ•mol-1;
a.反应前后气体物质的量不变,恒温恒容下,容器内压强保持不变,体系压强不变不能说明到达平衡,故a错误;
b.混合气体颜色保持不变,说明二氧化氮浓度不变,反应到达平衡,故b正确;
c.SO3和NO的体积比等于其化学计量数之比,始终保持不变,故c错误;
d.每消耗1mol SO3的同时生成1molNO2,均表示逆反应速率,反应始终按该比例关系进行,故d错误;
令NO2、SO2起始物质的量分别为1mol、2mol,转化的NO2为xmol,则:
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始量(mol):1 2 0 0
变化量(mol):x x x x
平衡量(mol):1-x 2-x x x
平衡时NO2与SO2体积比为1:6,则(1-x):(2-x)=1:6,解得x=0.8,反应气体气体体积不变,用物质的量代替浓度计算平衡常数,故平衡常数K=$\frac{c(S{O}_{3})×c(NO)}{c(N{O}_{2})×c(S{O}_{2})}$=$\frac{0.8×0.8}{(1-0.8)×(2-0.8)}$=$\frac{8}{3}$,
故答案为:-41.8;b;$\frac{8}{3}$.
点评 本题考查化学平衡计算、平衡状态判断、盖斯定律应用、氧化还原反应计算等,(2)注意对平衡常数表达式的理解.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
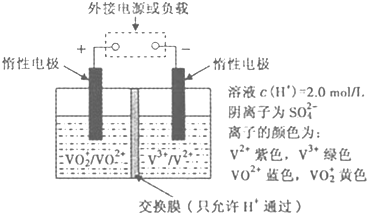
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
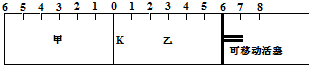
| A. | 右侧6处 | B. | 右侧6~7处 | C. | 右侧7处 | D. | 右侧7~8处 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
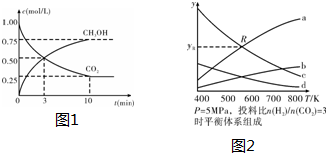
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H 2(g)+O 2(g)═2H 2O(g);△H=-483.6KJ•mol -1,则氢气的燃烧热为241.8kJ•mol -1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H 2O(1);△H=-57.4kJ•mol -1则含 20.0gNaOH的稀溶液与稀醋酸完全中和,放出小于28.7kJ的热量 | |
| C. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| D. | 己知2C(s)+2O 2(g)═2CO 2(g);△H=akJ•mol -1、2C(s)+O 2(g)═2CO(g);△H=bkJ•mol -1,则a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com