
| A. | 使用无毒无害的原料 | B. | 使用颜色为绿色的化工产品 | ||
| C. | 不使用任何化学物质 | D. | 使用不可再生的资源 |
科目:高中化学 来源: 题型:选择题
| A. | 1160 | B. | 2308 | C. | 1441 | D. | 2320 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制快速氨气可用浓氨水滴加到固体NaOH中 | |
| B. | 漂白粉的成分是NaCl与NaClO | |
| C. | 水玻璃应保存在具橡皮塞的玻璃试剂瓶中 | |
| D. | NO气体的收集不能用排空气法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
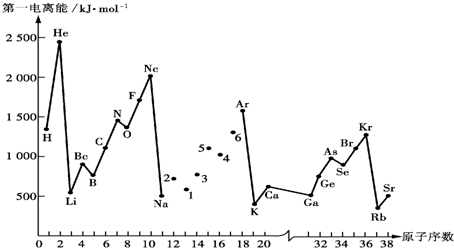
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
| C--C | C--N | C--S | |
| 键能 KJ/mol | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
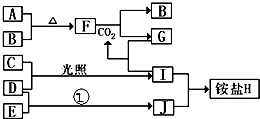 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种固氮反应.
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种固氮反应.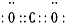 .
. 2NH3的化学方程式.
2NH3的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T/K | 催化剂用量/g | KMnO4酸性溶液浓度mol/L | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对反应速率的影响 (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的 影响; |
| ② | ||||
| ③ | 323 | |||
| ④ |
| KMnO4酸性溶液的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com