
分析 (1)FeS2的质量分数×FeS2中S元素质量分数=硫铁矿样品中S元素质量分数;
(2)根据方程式计算生成二氧化硫的体积;
(3)假设FeS2为4mol,为使FeS2煅烧完全生成Fe2O3,发生反应4FeS2+11O2=2Fe2O3+8SO2,利用方程式计算参加反应氧气、生成的二氧化硫以及气体物质的量减少的物质的量,进而计算通入的空气、反应后混合气体总物质的量,进而计算二氧化硫体积分数.
解答 解:(1)FeS2的质量分数×FeS2中S元素质量分数=硫铁矿样品中S元素质量分数,故FeS2的质量分数=$\frac{35%}{\frac{64}{120}}$=65.6%,
故答案为:65.6%;
(2)4FeS2 +11O2=2Fe2O3 +8SO2
4×120g 8×22.4L
1×106g V
V=$\frac{8×22.4L×1{0}^{6}g}{4×120g}$=3.733×105L=373.3m3,
故答案为:373.3;
(3)假设FeS2为4mol,则:
4FeS2+11O2=2Fe2O3+8SO2 气体物质的量减少
4 11 8 3
4mol 11mol 8mol 3mol
氧气过量20%,则通入氧气为11mol×(1+20%)=13.2,空气的物质的量为$\frac{13.2mol}{20%}$=66mol,故反应后混合气体总物质的量=66mol-3mol=63mol,
故所得炉气中SO2的体积分数=$\frac{8mol}{63mol}$×100%=12.7%,
故答案为:12.7%.
点评 本题考查化学反应的计算,把握方程式计算、守恒计算等为解答的关键,计算量较大,过程比较复杂,综合考查学生分析解决问题的能力,对学生的心理素质有较高的要求,题目难度中等


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
| 溶液 | 胶体 | 浊液 | |
| 光路示意图 |  |  |  |
| 对光的主要作用 | 透射 | 散射 | 反射或折射 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C、D四种元素可能属于同一周期 | |
| B. | A、B、C、D四种元素一定属于短周期元素 | |
| C. | 原子序数由大到小的顺序是B>A>C>D | |
| D. | 离子半径由大到小的顺序是、B2+>A+>C->D2- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲学生用50mL量筒量取46.70mL浓盐酸 | |
| B. | 乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 | |
| C. | 丙学生配NaOH溶液,用电子天平称取固体1.220g | |
| D. | 丁学生用红柄滴定管量取25.00mL0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | Na2SiO3溶液中通入过量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 大理石溶于醋酸的反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
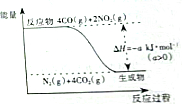 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应的特征是正反应速率和逆反应速率相等 | |
| B. | 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 | |
| C. | 在其他条件不变时,升高温度可以使平衡向正反应方向移动 | |
| D. | 对于反应A(g)+3B(g)?2C(g)△H<0达平衡后,温度降低,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


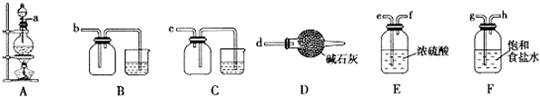
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com