
【题目】N0表示阿伏加德罗常数的值,下列说法正确的是
A. 1g H2所含分子数为N0
B. 2g D2O中所含的质子数为N0
C. 0.5 mol/L Na2SO4溶液中所含Na+ 数为N0
D. 标准状况下,4.48 L CCl4所含原子数为N0
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。
Ⅰ.从海水中提取食盐和溴![]() 海水中溴以溴化钠为主
海水中溴以溴化钠为主![]() 的过程如下:
的过程如下:
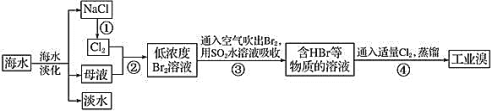
(1)工业上是利用步骤①所得的NaCl固体制备金属钠的化学方程式为:______。
(2)步骤②的离子方程式为:________。
(3)步骤③用![]() 水溶液吸收
水溶液吸收![]() ,可制得两种强酸,化学方程式为:_____。
,可制得两种强酸,化学方程式为:_____。
Ⅱ.海洋植物如海带、海藻中含有丰富的碘元素,燃烧的灰烬中碘元素以![]() 的形式存在。实验室里从海藻中提取碘的流程如下:
的形式存在。实验室里从海藻中提取碘的流程如下:
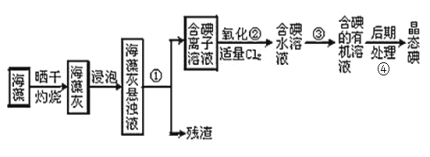
(4)指出提取碘的过程中有关的实验操作名称:
①_____③_____④______
(5)提取碘的过程中,可供选择的有机试剂是_____(填字母)。
A.苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生氧化还原反应。甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下(实验中所用KMnO4溶液均已酸化)
(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率,实验装置如图所示:

实验时仪器中的A溶液一次性加入,A、B的成分见下表:
序号 | A溶液 | B溶液 |
① | 2 mL 0.1 mol·L-1H2C2O4溶液 | 4 mL 0.01 mol·L-1KMnO4溶液 |
② | 2 mL 0.2 mol·L-1H2C2O4溶液 | 4 mL 0.01 mol·L-1KMnO4溶液 |
③ | 2 mL 0.2 mol·L-1H2C2O4溶液 | 4 mL 0.01 mol·L-1KMnO4溶液,少量MnSO4固体(催化剂) |
①盛放A溶液的仪器名称_______,锥形瓶中反应的化学方程式:______
②该实验探究的是_____因素对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是____(填实验序号)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的长短来比较化学反应速率。
取两支试管各加入2 mL 0.1 mol·L-1H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol·L-1KMnO4溶液,将四支试管分成两组(每组各有一支试管盛有H2C2O4溶液和KMnO4溶液),一组放入冷水中,另一组放入热水中,一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究________因素对化学反应速率的影响,但该组同学始终没有看到溶液完全褪色,其原因是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2 mol A气体和2 mol B气体通入体积为2 L的密闭容器中发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_______________________
(2)x=________。
(3)A的转化率为_____________。
(4)下列各项可作为该反应达到平衡状态的标志的是________。
A.压强不再变化
B.气体密度不再变化
C.气体的平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)1 mol C2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411 kJ能量: 。
(2)1 mol C2H5OH(l)与适量O2(g)反应生成CO2(g)和H2O(l),放出1366.8 kJ热量: 。
(3)2 mol Al(s)与适量O2(g)发生反应生成Al2O3(s),放出1669.8 kJ热量: 。
(4)在200°C、101 kPa时,1 mol H2与碘蒸气作用生成HI气体,放出14.9 kJ热量: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮能与水反应生成硝酸和一氧化氮,关于该反应的说法中正确的是( )
A.二氧化氮是氧化剂,水是还原剂B.二氧化氮是还原剂,水是氧化剂
C.二氧化氮既是氧化剂又是还原剂D.二氧化氮既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定,请回答下列问题:

(1)做1次完整的中和热测定实验,温度计至少需使用________次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?_______________。
(2)实验室用50 mL 0.50 mol·L-1盐酸,50 mL 0.55 mol·L-1 NaOH溶液进行测定中和热的实验,为了把测量数据记录下来,请你设计表格__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g) ![]() N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______________。
(2)某研究小组模拟研究如下:向2 L恒容密闭容器中充入2 mol NO发生反应2NO(g) ![]() N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
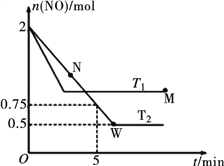
①T2下,在0~5 min内,v(O2)=______________mol·L-1·min-1;该温度下反应N2(g)+O2(g) ![]() 2NO(g)的平衡常数K=______________。
2NO(g)的平衡常数K=______________。
②该反应进行到M点放出的热量______________进行到W点放出的热量(填“>”、“<”或“=”)。
M点时再加入一定量NO,平衡后NO的转化率______________(填“变大”、“变小”或“不变”)。
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是______________(填序号)。
a.混合气体的密度 b.逆反应速率
c.单位时间内,N2和NO的消耗量之比 d.气体的平均相对分子质量
(3)氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) ![]() LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
A.增加LaNi5H6(s)的量 B.升高温度
C.使用催化剂 D.减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示:
C(g)+D(g)过程中的能量变化如图所示:

完成下列填空:
(1)该反应是__________反应(选填“吸热”、“放热”),该反应化学平衡常数表达式为K=____。
(2)在恒温恒容条件下,能判断该反应达到平衡状态的依据是____________。(用文字表示)
(3)若在体系中加入合适的催化剂,则该反应的化学反速率_________,反应的热效应_____(均选填“增大”、“减小”或“不变”)。
(4)达到平衡时,改变一个条件,化学平衡常数不变,A的转化率增大,则该条件是_______。
(5)FeCl3固体溶于蒸馏水常会出见浑浊,得不到澄清的氧化铁溶液。其原因是_________,如果要得到澄清的氯化铁溶液,可采取的措施是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com