
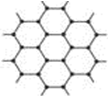
 金刚石是常见的原子晶体,若某块金刚石中有n个碳原子,则其中的共价键数目是
金刚石是常见的原子晶体,若某块金刚石中有n个碳原子,则其中的共价键数目是| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
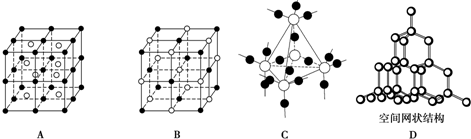
| 3 |
| ||
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
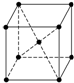
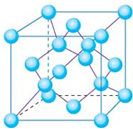 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.| 2880 |
| NA |
| 2880 |
| NA |
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 晶 体 | 氯化钠 | 氯化钡 | 金刚石 | 二氧化硅 | 硫 | 白磷 | 钠 | 钨 |
| 熔点 0C | 801 | 1560 | 3550 | 1723 | 112.8 | 44.1 | 97.8 | 3410 |
| 硬 度 | 较 硬 | 较 硬 | 很 硬 | 硬 脆 | 脆 | 软 | 柔 软 | 硬 |
| 晶体类 型 | ||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
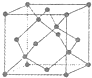 [化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.
[化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com