
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Zn2+的浓度不变 | |
| B. | 沉淀溶解后,将生成配合离子[Zn(NH3)4]2+ | |
| C. | 用硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样的现象 | |
| D. | 在[Zn(NH3)4]2+离子中,NH3给出孤对电子,Zn2+提供空轨道 |
分析 向硫酸锌溶液中加入氨水,氨水先和硫酸锌反应生成氢氧化锌沉淀,继续添加氨水,氨水和氢氧化锌反应生成可溶性的锌氨络合物.
A.硫酸锌先和氨水反应生成氢氧化锌,氢氧化锌和氨水反应生成络合物;
B.氢氧化锌和氨水反应生成配合物而使溶液澄清;
C.硝酸锌中的锌离子和氨水反应现象与硫酸锌中锌离子和氨水反应现象相同,硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样现象;
D.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键.
解答 解:A.硫酸锌和氨水反应生成氢氧化锌沉淀,继续加氨水时,氢氧化锌和氨水继续反应生成络合物而使溶液澄清,所以溶液中锌离子浓度减小,故A错误;
B.硫酸锌和氨水反应生成氢氧化锌沉淀,继续加氨水时,氢氧化锌和氨水继续反应生成络合物离子[Zn(NH3)4]2+而使溶液澄清,故B正确;
C.硝酸锌中的锌离子和氨水反应现象与硫酸锌中锌离子和氨水反应现象相同,硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样现象,故C正确;
D.在[Zn(NH3)4]2+离子中,Zn2+提供空轨道,NH3提供孤电子对,故D正确;
故选A.
点评 本题考查了配合物、配位键的形成等性质,难度不大,明确形成配合物的条件是:有提供空轨道的中心原子,有提供孤电子对的配位体.


科目:高中化学 来源: 题型:选择题
| A. | 发生爆炸的天津滨海仓库存放的电石、氰化钠和硝酸铵等危险化学品均属于电解质 | |
| B. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 | |
| C. | 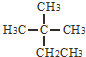 的系统命名为:2-甲基-2-乙基丙烷,其一氯代物有5种 的系统命名为:2-甲基-2-乙基丙烷,其一氯代物有5种 | |
| D. | 1mol化合物(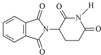 )跟足量NaOH溶液反应最多耗4molNaOH )跟足量NaOH溶液反应最多耗4molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
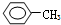
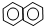
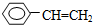
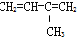
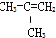
| A. | ④和⑥ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 金属性:D>C | |
| D. | D单质能够溶解于C的最高价氧化物对应的水化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤ | C. | ③④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| M | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 第四周期过渡元素,其价电子层各能级处于半充满状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示的分子式为C6H14;名称是2-甲基戊烷.
表示的分子式为C6H14;名称是2-甲基戊烷.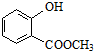 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常见单质的沸点:W>Y>Z | |
| B. | W的氢化物为共价化合物 | |
| C. | 原子半径:Y<Z<W | |
| D. | X、Y可以形成既有极性键也有非极性键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 气化反应式 | 1gK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com