
下列说法正确的是( )
A.分子式为CH4O和C2H6O的物质一定互为同系物
B.甲烷、乙烯和苯在工业上都可通过石油分馏得到
C.苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠
D.1 mol 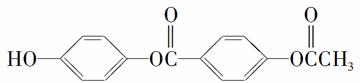 与过量的NaOH溶液加热充分反应,能消耗5 mol NaOH
与过量的NaOH溶液加热充分反应,能消耗5 mol NaOH
科目:高中化学 来源: 题型:
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeC l3 高效,且腐蚀性小。请回答下列问题:
l3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3 。
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:
| |
 ClO3-+
ClO3-+
|
 Fe2++
Fe2++ | |
 =
= | |
 Cl-+
Cl-+ | |
 Fe3++
Fe3++ | |

 .
. (3)FeCl3 在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
 xFe3++yH2O
xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
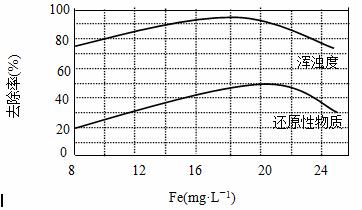
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是( )
A.2SO2+O2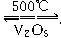 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+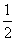 O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
 (2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
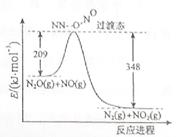
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2, 其△H= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.糖类化合物都具有相同的官能团
B.酯类物质是形成水果香味的主要成分
C.油脂的皂化反应生成脂肪酸和丙醇
D.蛋白质的水解产物都含有羧基和羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示。下列有关黄曲霉毒素M1的说法正确的是( )
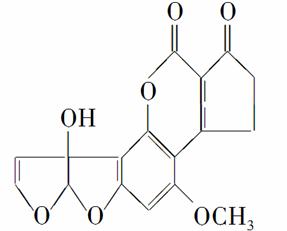
A.黄曲霉毒素M1的分子式为C17H14O7
B.黄曲霉毒素M1含有羟基,此羟基能被催化氧化为醛基
C.1 mol黄曲霉毒素M1与NaOH溶液发生反应最多能消耗2 mol NaOH
D.1 mol黄曲霉毒素M1最多能 与7 mol H2发生加成反应
与7 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
酯是重要的有机合成中间体,广泛应 用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法中常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制备。
用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法中常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制备。
请根据要求回答下列问题。
(1)写出该反应的化学方程式:_______________________。
(2)此反应中浓硫酸的作用是__________________________,
饱和碳酸钠溶液的作用是___________________________。
(3)若采用同位素示踪法研究该化学反应,反应物无水乙醇中含有18O,冰醋酸中均为16O,反应后的混合物中,含有18O的物质有________。
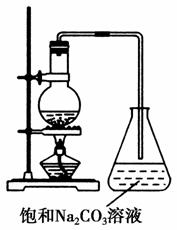
(4)若用如图所示装置来制备少量的乙酸乙酯,锥形瓶中的现象为______________________,不过往往产率偏低,其原因可能为____________________(任填2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或事故处理正确的是( )。
A.金属钠着火,立即用水扑灭 B.实验结束后,用嘴吹灭酒精灯
C.皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗
D.稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上可用铝槽储装浓硝酸,其原因是( )。
A.浓硝酸是弱酸 B.浓硝酸的氧化性比较弱
C.铝表面可被氧化生成一层致密的保护膜
D.铝的化学性质不活泼,不能够与浓硝酸发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com