
分析 (1)反应①中只有Cl元素化合价发生变化;
(2)反应②中C元素化合价升高,O元素化合价降低;
(3)反应③中Mn元素化合价降低,Cl元素化合价升高.
解答 解:(1)反应①中只有Cl元素化合价发生变化,Cl元素化合价由0价分别分别变化为+5价、-1价,被氧化与被还原的氯元素的质量之比为1:5,故答案为:1:5;
(2)反应②中C元素化合价升高,O元素化合价降低,被还原的元素为O,故答案为:O;
(3)反应③中Mn元素化合价降低,Cl元素化合价升高,由方程式可知当有4molHCl参加反应,有2mol被氧化,被氧化和未被氧化的Cl-的个数比为1:1,
故答案为:1:1.
点评 本题综合考查氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,注意把握氧化还原反应的相关概念与化合价的关系,难度不大.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | O2浓度增加 | C. | O2压强不变 | D. | BaO量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol CO、1mol O2 | 2mol CO2 | 4mol CO2 |
| CO2的浓度(mol•L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出aKJ | 吸收bKJ | 吸收CkJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| A. | 2c1<c3 | B. | a+b=283.0 | C. | 2p2>p3 | D. | c1=c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度的溶液中滴入稀盐酸.放出气体的快慢Na2C03<NaC03 | |
| B. | 热稳定性Na2C03<NaHC03 | |
| C. | 常温时水溶性Na2C03<NaHC03 | |
| D. | 相对分子质量Na2C03<NaHC03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
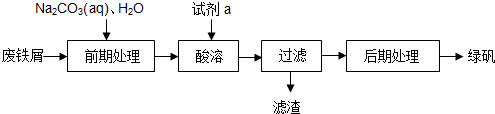
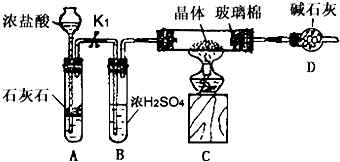
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com