
| A. | 含有0.6mol Ca2+ | B. | 含有0.3mol Cl- | ||
| C. | n(Na+):n(OH-)=1:5 | D. | 所含元素中钙元素的质量很大 |
分析 A.由化学式可知n(Ca2+)=n[Ca(OH)2]+n( CaCl2);
B.n(Cl-)=2n( CaCl2);
C.n(Na+)=n(NaOH),n(OH-)=n(NaOH)+2n[Ca(OH)2];
D.根据m=nM计算判断.
解答 解:A.由化学式可知n(Ca2+)=n[Ca(OH)2]+n( CaCl2)=0.2mol+0.3mol=0.5mol,故A错误;
B.n(Cl-)=2n( CaCl2)=2×0.3mol=0.6mol,故B错误;
C.n(Na+)=n(NaOH)=0.1mol,n(OH-)=n(NaOH)+2n[Ca(OH)2]=0.5mol,故n(Na+):n(OH-)=1:5,故C正确;
D.Ca元素质量为0.5mol×40g/mol=20g,Na元素质量为0.1mol×23g/mol=2.3g,Cl元素质量为0.6mol×35.3g/mol=21.3g,O元素质量为0.5mol×16g/mol=8g,H元素质量为(0.1mol+0.4mol)×1g/mol=0.5g,则氯元素质量最大,故D错误.
故选:C.
点评 本题考查物质的量有关计算,侧重微粒数目的计算,注意对化学式的理解,题目比较基础.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
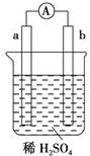
| A. | 碳棒上有气体放出,溶液pH变大 | |
| B. | a是正极,b是负极 | |
| C. | 稀硫酸中有电子流动,方向是从b极到a极 | |
| D. | a极上发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:X的氢化物>Y的氢化物>Z的氢化物 | |
| B. | 简单离子的半径:Y的离子>Z的离子>M的离子>X的离子 | |
| C. | YX2、M2Y都含有极性键 | |
| D. | Z元素的最高价氧化物的水化物的化学式为H2ZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
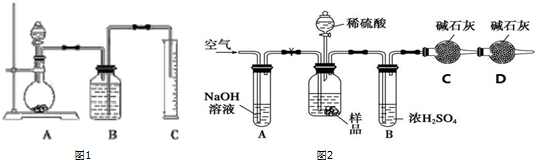
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com