
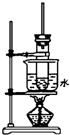
 如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).
如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).分析 (1)水浴加热时试管底部与烧杯底部处于接触状态,无法控制反应温度;
(2)反应有大量热放出,苯酚、甲醛溶液易挥发,防止反应物因剧烈沸腾而蒸发掉.反应装置中的长玻璃管对挥发的反应物起冷凝回流作用;
(3)酚醛树脂实验中通常使用酸作催化剂;
(4)这个实验中,所用苯酚过量,并用酸作催化剂,产物是线型高分子树脂,实验后的反应容器,需用酒精浸泡一些时间后,才易用水洗净.
解答 解:(1)装置中存在的一处错误是试管底部与烧杯底部接触,故答案为:试管底部与烧杯底部接触;
(2)反应有大量热放出,苯酚、甲醛溶液易挥发,反应装置中的长玻璃管除导气外,还对对挥发的反应物起冷凝回流作用,故答案为:导气冷凝回流;
(3)实验中使用浓盐酸作催化剂,故答案为:催化剂;
(4)酚醛树脂是线型高分子树脂,难溶于水,易溶于有机溶剂酒精,需用酒精浸泡一些时间后,才易用水洗净,故答案为:乙醇.
点评 本题考查常见仪器的使用和酚醛树脂的制取,题目难度不大,注意常见化学仪器的使用方法和注意事项.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 温度 转化率 压强 | 500K | 600K |
| P | 60% | b |
| 1.5P | a | 55% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
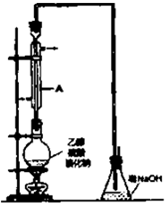 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O.
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
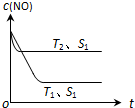 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c (NO)(×10-3 mol•L-1) | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
| c (CO)(×10-3 mol•L-1) | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H2 | B. | 2molCl2 | C. | 1.5NACO2 | D. | 22.4LO2(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量就等于物质的式量 | |
| B. | 摩尔质量就是物质式量的6.02×1023倍 | |
| C. | HNO3的摩尔质量是63g | |
| D. | H2SO4和H3PO4的摩尔质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 点燃爆竹后,硫燃烧生成SO3 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com