
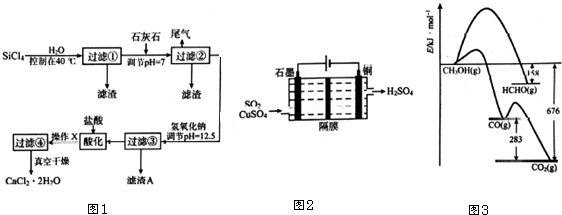
分析 四氯化硅控制温度40°C,加入水过滤得到原硅酸,则发生水解反应生成原硅酸和氯化氢,过滤得到盐酸溶液,加入石灰石主要成分为CaCO3,且含少量Na+、Al3+、Fe3+、SO32-杂质离子,CaCO3和盐酸反应转化为CaCl2,SO32-转化为SO2,溶液中H+减少,调节溶液pH=7,Fe3+沉淀为氢氧化铁,过滤后的滤液中含有Na+、Al3+和Cl-,向滤液中加20%NaOH调节pH=12.5,生成氢氧化铝沉淀,过滤过滤后滤液中主要为CaCl2、NaCl及未反应的NaOH,再加入盐酸酸化,将NaOH转化为NaCl,利用氯化钠、氯化钙溶解度受温度影响不同,采取重结晶析出CaCl2•2H2O,过滤、洗涤、干燥后得CaCl2•2H2O.
(3)根据Ca元素质量守恒计算m(CaCl2•2H2O);最后利用氯化钠、氯化钙溶解度受温度影响不同,采取重结晶得到CaCl2•2H2O,可能含有少量NaCl;
(4)由电解池装置图,可知阳极上是二氧化硫失去电子,被氧化为硫酸根;
(5)根据盖斯定律,由图可知,1mol HCHO燃烧生成CO(g)、H2O(g)放出的热量为676kJ-283kJ-168kJ=225kJ,据此计算.
解答 解:四氯化硅控制温度40°C,加入水过滤得到原硅酸,则发生水解反应生成原硅酸和氯化氢,过滤得到盐酸溶液,加入石灰石主要成分为CaCO3,且含少量Na+、Al3+、Fe3+、SO32-杂质离子,CaCO3和盐酸反应转化为CaCl2,SO32-转化为SO2,溶液中H+减少,调节溶液pH=7,Fe3+沉淀为氢氧化铁,过滤后的滤液中含有Na+、Al3+和Cl-,向滤液中加20%NaOH调节pH=12.5,生成氢氧化铝沉淀,过滤过滤后滤液中主要为CaCl2、NaCl及未反应的NaOH,再加入盐酸酸化,将NaOH转化为NaCl,利用氯化钠、氯化钙溶解度受温度影响不同,采取重结晶析出CaCl2•2H2O,过滤、洗涤、干燥后得CaCl2•2H2O.
(1)由上述分析可知,滤渣A的主要成分是Al(OH)3;操作X的方法为:重结晶,
故答案为:Al(OH)3;重结晶;
(2)四氯化硅水解生成原硅酸和氯化氢,反应方程式为:SiCl4+4H2O=H4SiO4↓+4HCl,
故答案为:SiCl4+4H2O=H4SiO4↓+4HCl;
(3)根据Ca元素质量守恒:n(CaCl2•2H2O)=n(CaCO3),则m(CaCl2•2H2O)=n(CaCl2•2H2O)×M(CaCl2•2H2O)=$\frac{100t×80%}{100g/mol}$×147g/mol=117.6t;
最后利用氯化钠、氯化钙溶解度受温度影响不同,采取重结晶得到CaCl2•2H2O,可能含有少量NaCl,
故答案为:117.6;NaCl;
(4)由电解池装置图,可知阳极上是二氧化硫失去电子,被氧化为硫酸根,电极反应式为:SO2+2H2O-2e-═SO42-+4H+,
故答案为:SO2+2H2O-2e-═SO42-+4H+;
(5)根据盖斯定律,由图可知,1mol HCHO燃烧生成CO(g)、H2O(g)放出的热量为676kJ-283kJ-168kJ=225kJ,则2HCHO(g)+O2(g)═2CO(g)+2H2O(g)的△H=-(2×225)kJ/mol=-450kJ/mol,
故答案为:-450kJ/mol.
点评 本题考查制备实验方案、物质分离和提纯、电解原理、化学计算、反应热计算等,充分考查了学生的分析、理解能力及知识迁移运用的能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸反应 Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钡溶于稀盐酸中 BaCO3+2H+=Ba2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能使溴水褪色 | B. | 淀粉水解的最终产物是葡萄糖 | ||
| C. | 葡萄糖、蔗糖都能水解 | D. | 油脂从分类上说属于不饱和烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ H+ HCO3- | B. | Na+ NO3- Cl- | C. | H+ OH- SO42- | D. | Ca2+ K+ CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol/L | B. | 0.2 mol/L | C. | 0.25 mol/L | D. | 0.3 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com