
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下:

回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
|
步骤 |
实验目的 |
试剂 |
现象 |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
(2)由溶液甲生成沉淀乙的离子方程式: ;
(3)综上所述,该溶液中肯定存在的离子有: 。
(4)针对溶液中可能存在的离子,用实验验证其是否存在的方法是
。
(1)2S2- + SO32- + 6H+ = 3S↓+ 3H2O; (2分)
(3分,检验SO2、除尽SO2 、检验CO2 各1分)
|
步骤 |
实验目的 |
试剂 |
现象 |
|
1 |
检验SO2 |
品红溶液 |
红色退去 |
|
2 |
除尽SO2 |
酸性高锰酸钾溶液 |
紫色变浅或不完全褪去 |
|
3 |
检验CO2 |
澄清石灰水 |
变浑浊 |
|
4 |
|
|
|
(2)Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑; (2分)
(3)S2-、SO32-、AlO2-、Na+ 、CO32-。 (2分)
(4)取沉淀丙加入足量稀盐酸,若沉淀不能完全溶解,则原溶液中含SO42-,沉淀全部溶解,则原溶液中无SO42-。(答案合理给分)(2分)
【解析】
试题分析:首先分析离子间的反应,如Ag+与题目所给的所以阴离子都能反应,不能大量共存,所以原溶液不含Ag+,然后在根据框图中的现象进一步分析,推出溶液所含的离子。
(1)原溶液不含Ag+,所以淡黄色沉淀甲不是AgBr,为SO32‾与S2‾在酸性条件下反应生成的S单质沉淀,所以离子方程式为:2S2- + SO32- + 6H+ = 3S↓+ 3H2O;气体甲由两种氧化物组成(不包括水蒸汽和HBr),因为氢溴酸为强酸,能与CO32‾和SO32‾反应生成CO2和SO2气体,所以气体甲含有的两种氧化物为SO2和CO2,首先利用SO2的漂白性,通入品红溶液检验SO2,为了防止SO2对CO2检验的干扰,第2步应利用SO2的还原性,通入酸性KMnO4除去SO2,然后再通入澄清石灰水,检验CO2的存在。
(2)因为Ba2+、Al3+不能与CO32‾、SO32‾共存,所以加入NH4HCO3后产生白色沉淀,说明原溶液含有AlO2-,加入过量氢溴酸后,转化为Al3+,Al3+与HCO3‾反应生成Al(OH)3沉淀,离子方程式为:Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑。
(3)根据(1)可推出原溶液含有S2‾、SO32‾、CO32‾;根据(2)可推出原溶液含有AlO2-;Ag+、Ba2+、Al3+与SO32‾、CO32‾等离子不能大量共存,根据溶液呈中性,所以原溶液还一定含有Na+。
(4)根据题目所给信息不能确定的离子为SO42‾,沉淀甲一定含BaCO3,若含有SO42‾,沉淀丙中还含有BaSO4,加入足量稀盐酸,沉淀不能完全溶解,若沉淀全部溶解,则原溶液中无SO42-。
考点:本题考查离子的推断、离子方程式的书写、气体的检验。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2014届河北省高三调研考试理综化学试卷(解析版) 题型:填空题
周期表中前36号元素A、B、C、D、E、F、G、H,它们的原子序数依次增大,其中B、C、D为同一周期;E、F、G为同一周期;A和E、D和G分别为同一主族;A与B组成的化合物是一种温室气体;D元素原子的最外层电子数是次外层电子数的3倍;E是所在周期原子半径最大的元素(除稀有气体外);F元素的离子半径是同周期元素形成的简单离子中最小的;H元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
(1)E2D2物质中化学键的类型是__________________
(2)一定条件下,A2气体与C2气体充分反应可生成6.8 g的气体,放出18.44 kJ热量,则该反应的热化学方程式为:______________________________________________________;生成物分子的空间构型为_________________,其中C的杂化方式为_______________。
(3)C和E组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
(4)H的基态原子的电子排布式为__________________________已知H2+能与(2)中的生成物的水溶液形成配合物,请写出该配合物中阳离子的结构简式:_________________,在此配合物的水溶液中加入乙醇,现象是_______________________________________。
(5)某无色溶液可能存在如下离子:Ag+、Ba2+和由上推出的元素组成的离子E+、F3+、FD2―、G2―、BD32―、GD32―、GD42―,现取该溶液进行有关实验,结果如下图所示。
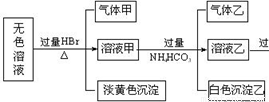
①生成淡黄色沉淀的离子方程式为 。
②由溶液甲生成沉淀乙的离子方程式 。
③综合上述信息,可以肯定存在的离子有 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三第三次质量检测化学试卷 题型:选择题
下列有关实验原理、方法和结论都正确的是
A.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶,除去干燥的CO2中混有的少量SO2
D.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市高三下学期开学检测化学试卷 题型:选择题
下列有关实验原理、方法和结论都正确的是
A.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶,除去干燥的CO2中混有的少量SO2
D.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理、方法和结论都正确的是
A.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶,除去干燥的CO2中混有的少量SO2
D.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com