
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是

A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
【答案】B
【解析】
A. a点表示0.1mol·L-1一元弱碱XOH,若a=-8,则c(OH-)=10-3mol/L,所以Kb(XOH)≈![]() =
=![]() =10-5,故A正确;
=10-5,故A正确;
B. 两者恰好反应时,生成强酸弱碱盐,溶液显酸性。M点AG=0,则溶液中c(H+)= c(OH-),溶液呈中性,所以溶质为XOH和XCl,两者不是恰好完全反应,故B错误;
C. 若R点恰好为XCl溶液时,根据物料守恒可得c(X+)+c(XOH)=c(C1-),故C正确;
D. M点的溶质为XOH和XCl,继续加入盐酸,直至溶质全部为XCl时,该过程水的电离程度先增大,然后XCl溶液中再加入盐酸,水的电离程度减小,所以从M点到N点,水的电离程度先增大后减小,故D正确。
故选B。


科目:高中化学 来源: 题型:
【题目】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1mol水蒸气的能量变化示意图。写出该反应的热化学方程式___________。

(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应I:2NO(g)![]() N2O2(g)(快);H1<0 v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
N2O2(g)(快);H1<0 v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
反应Ⅱ:N2O2(g)+O2(g)![]() 2NO2(g)(慢);△H2<0 v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2 (NO2);
2NO2(g)(慢);△H2<0 v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2 (NO2);
①一定条件下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
反应I的活化能EI___________反应Ⅱ的活化能EII(填“>”、“<”、或“=”)。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数___________k2逆增大的倍数(填“大于”、“小于”、或“等于”)。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

①装置中H+向___________池迁移。
②乙池溶液中发生反应的离子方程式:______________________。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为___________。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A. 一定得到电子B. 一定失去电子
C. 可能被氧化也可能被还原D. 以上都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含铜化合物的化学式为Cux(OH)y(CO3)z(Cu为+2价)。取该样品22.2 g,充分加热后,得到黑色固体氧化铜16.0 g,则该物质的化学式为
A.Cu2(OH)4CO3B.Cu3(OH)4CO3
C.Cu2(OH)2CO3D.Cu4(OH)2(CO3)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: A是石油裂解气的主要成份且A的产量通常用来衡量一个国家的石油化工水平;D是常用作厨房中调味品。请回答下列问题:

(1)写出C的结构简式________________________。
(2)写出下列反应的反应类型: ①________________,④________________。
(3)写出下列反应的化学方程式:
②______________________________________________________________。
⑤______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I(C9H12O2)是合成某功能高分子材料的中间体,由C2H4和![]() 合成的路线如图所示:
合成的路线如图所示:

已知:i、RCHO+CH3CHO![]() RCH=CHCHO+H2O(R为代表烃基或氢原子)
RCH=CHCHO+H2O(R为代表烃基或氢原子)
ii、![]()
回答下列问题:
(1)试剂X的名称______________________。
(2)E的结构简式为______________________。
(3)反应④的类型是______________________。
(4)D中所含的官能团名称是______________________。
(5)写出反应⑤的化学方程式:_________________________________。
(6)同时符合下列条件的I的同分异构体共有___________种(不考虑立体异构),其中核磁共振氢谱图表明分子中有5种氢原子的为___________(写1种结构简式)。a.分子中含有苯环且苯环上有三个取代基;b.1mol有机物最多能消耗2 mol NaOH。
(7)设计以乙醛和1,3-丁二烯(CH2=CHCH=CH2)为原料制备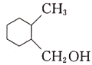 的合成路线:________ (用流程图表示,无机试剂任选)。
的合成路线:________ (用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)《2017年江苏省政府工作报告》提出“深度参与‘一带一路’建设,全面实施国际产能合作三年行动计划”。
①畅通信息丝绸之路,需要规划建设洲际海底光缆项目。生产光缆所用的光导纤维属于_______(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
②沪通铁路的建成将江苏沿海进一步融入上海都市圈。金属防腐是铁路建设的重要课题,下列做法的目的不是为了防腐的是_______(填字母)。
a.将钢轨打磨 b.将钢轨涂刷沥青 c.将钢轨与铝连接
③“一带一路”建设需要用大量水泥。生产水泥的主要原料为石灰石和_______(填字母)。
a.纯碱 b.石英 c.黏土
(2)芦蒿是江苏人喜爱的食材,每100g嫩茎中含有蛋白质3.6g、钙730mg、铁2.8mg、胡萝卜素1.4mg、维生素C 49mg等。

①芦蒿中属于微量元素的是_______,还缺少的给人体提供能量的营养素是________。
②β—胡萝卜素在食品工业常用作__________。
③每100g上述芦蒿嫩茎中含有的蛋白质完全水解,所得氨基酸的总质量________3.6g(填“>”、“<”或“=”)。
④维生素C能防治坏血病,又称为抗坏血酸。在维生素C溶液中滴入少量__________,可观察到溶液蓝色褪去,说明维生素C具有还原性。
(3)健康江苏2030规划纲要明确要求“实施最严格的环境保护制度,切实解决影响人民群众健康的突出环境问题”。
①下图为2017年除夕至初一全国部分城市PM2.5小时值浓度变化图。空气质量最好的城市是_________,原因是采取了烟花爆竹禁放措施;燃放烟花爆竹还会释放出大量的SO2等有害气体,写出SO2在空气中形成硫酸型酸雨的总化学方程式:___________________________。

②家庭生活要注意防止和减少对环境的污染。家居装修时要选择优质胶合板,原因是防止___________(填物质名称)产生污染;用过的聚乙烯塑料食品袋要投入贴有_________标志的垃圾箱中。
③对含氮废水进行有效的检测和合理的处理是人们研究和关心的重要问题。环境专家认为可以用金属镁将水体中的NO3-还原为N2,此时所得溶液呈碱性。该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com