
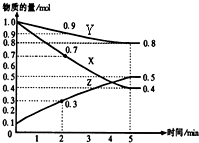
 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示:分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)依据化学反应速率计算公式v=$\frac{△c}{△t}$=$\frac{△n}{\frac{V}{△t}}$计算.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=(1-0.4)mol:(1-08)mol:(0.5-0.1)mol=0.6mol:0.2mol:0.4mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)反应开始至2min时v(Z)=$\frac{△c}{△t}$=$\frac{△n}{\frac{V}{△t}}$=$\frac{0.3mol-0.1mol}{\frac{2L}{2min}}$=0.05mol/(L•min),
反应开始至5min时v(Z)=$\frac{△c}{△t}$=$\frac{△n}{\frac{V}{△t}}$=$\frac{0.5mol-0.1mol}{\frac{2L}{5min}}$=0.04 mol/(L•min),
故答案为:0.05 mol/(L•min);0.04 mol/(L•min).
点评 本题考查了化学平衡图象分析,平衡状态的分析判断,题目难度不大,注意分析各物质的量的变化曲线,把握化学方程式的判断方法,注意化学反应速率计算公式熟练应用.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 生铁比软铁芯(几乎是纯铁)容易生锈 | |
| B. | 银质奖牌久置后表面变暗 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子由Al电极通过外电路流向Ag2O/Ag电极 | |
| B. | 电池负极附近溶液pH升高 | |
| C. | 正极反应式为:Ag2O+2e-+H2O=2Ag+2OH- | |
| D. | 负极会发生副反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 乳酸[CH3CH(OH)COOH]有一对对映异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | SiCl4的分子中硅氯键的极性比CCl4中的碳氯键强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com