
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | B. | 16O与18O互为同位素 | ||
| C. | 氯离子的结构示意图: | D. | NaClO的电子式: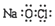 |
分析 A.质量数=质子数+中子数,元素符号的左上角表示质量数、左下角为质子数;
B.同位素为同种元素的不同原子之间的互称;
C.氯离子核内17个电子,核外18个电子;
D.次氯酸钠为离子化合物,阴阳离子需要标出所带电荷,次氯酸根离子还需要标出最外层电子;
解答 解:A.氯原子的质子数为17,质量数为35的氯原子应该表示为:1735Cl,故A错误;
B.16O与18O是氧元素的不同原子,互为同位素,故B正确;
C.Cl-的质子数为17,核外电子总数为18,离子结构示意图为: ,故C错误;
,故C错误;
D.NaClO是离子化合物,Na+和ClO-间为离子键,在Cl和O之间为共价键,其电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、原子符号、离子结构示意图、同位素等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
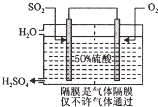 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 方案 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |  |
| ① | 浓硝酸 | Na2S | AgCl溶液 | NaOH溶液 | |
| ② | 浓醋酸 | CaCO3 | NaOH溶液(过量) | Na2SiO3溶液 | |
| ③ | 浓盐酸 | KMnO4 | NaBr溶液 | KI溶液 | |
| ④ | 浓硫酸 | 蔗糖 | KMnO4溶液(过量) | 石灰水 |
| A. | 用①来验证溶解度:S(Ag2S)<S(AgCl) | |
| B. | 用②来验证酸性:CH3COOH>H2CO3>H2SiO3 | |
| C. | 用③来验证氧化性:KMnO4>Cl2>Br2>I2 | |
| D. | 用④来验证蔗糖与浓硫酸作用后有SO2和CO2产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
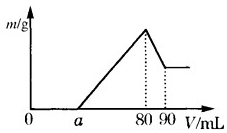 (1)把一定质量的镁、铝混合物投入到 2mol•L-1 的盐酸中,待金属完全溶解后,向溶液中加入 2mol•L-1 的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
(1)把一定质量的镁、铝混合物投入到 2mol•L-1 的盐酸中,待金属完全溶解后,向溶液中加入 2mol•L-1 的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的相差4 |
| F 是前四周期原子电子排布图中单电子数最多的元素 |
| G在周期表的第十一列 |
 .
.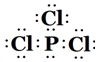 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16gO2占有的体积约为11.2L | |
| B. | 22.4LH2含有阿伏加德罗常数个氢分子 | |
| C. | 在标准状况下,44.8LH2O的质量约为36g | |
| D. | 11gCO2与标准状况下5.6LHCl含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
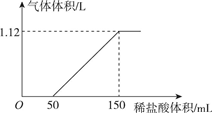 向某碳酸钠和碳酸氢钠的混合溶液中逐滴加入0.05mol/L的稀盐酸,加入稀盐酸体积与标准状况下产生气体体积的关系如图所示.
向某碳酸钠和碳酸氢钠的混合溶液中逐滴加入0.05mol/L的稀盐酸,加入稀盐酸体积与标准状况下产生气体体积的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 | B. | ll | C. | 13 | D. | 15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com