
用NA表示的值,下列说法正确的是
A.24.5L氢气中所含氢原子数一定大于2NA
B.lmolCH3+电子数为9NA
C.l00g 60%CH3COOH水溶液中含有的分子数为NA
D.常温常压下0.lmol CO和NO的混合气体含氧原子数为0.lNA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届广西柳州铁路第一中学高三上学期10月月考理化学试卷(解析版) 题型:推断题
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
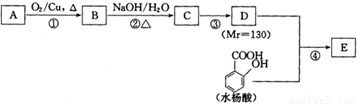
已知:2RCH2CHO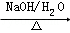
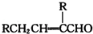
请回答下列问题:
(1)饱和一元醇A中氧的质量分数约为21.6%,则A的分子式为 。结构分析显示A只有一个甲基,则A的名称为 。
(2)B能发生银镜反应,该反应的化学方程式为 。
(3)C中含有官能团的名称为 ;若一次取样,检验C中所含官能团,按使用的先后顺序写出所用试剂 。
(4)第③步的反应类型为 ;D的一种同分异构体M的核磁共振氢谱显示只有一种峰,写出M的结构简式 。
(5)写出E的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高一上期中考试化学试卷(解析版) 题型:选择题
能够用来鉴别BaCl2、NaCl、Na2CO3三种物质的试剂是
A.AgNO3溶液 B.稀硫酸 C.稀盐酸 D.稀硝酸
查看答案和解析>>
科目:高中化学 来源:2016届北京市朝阳区高三上学期期中统考化学试卷(解析版) 题型:选择题
微电解法是利用原电池原理处理、净化高浓度有机废水的一种理想方法。在酸性、充入氧
气条件下的铁碳微电解法处理有机废水的过程中,有如下一些反应:
① O2+ 4H++4e-= 2H2O
② O2+ 2H2O+ 4e-= 4OH-
③ 4Fe2++O2+4H+= 2H2O+ 4Fe3+
......
下列有关这种铁碳微电解法处理有机废水说法不合理的是
A.在处理废水的过程中,pH升高
B.铁做负极,电极反应式是 Fe-2e-= Fe2+
C.处理、净化过程中发生的反应都是氧化还原反应
D.Fe(OH)3胶体,可净化除去废水中的悬浮物
查看答案和解析>>
科目:高中化学 来源:2016届福建省、霞浦七中、周宁十中高三上期中联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.标准状况下,2.24 L Cl2与足量的稀NaOH溶液反应,转移电子总数为0.2NA
B.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
C.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
D.标准状况下,0.1NA的SO3的体积约为2.24 L
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古鄂尔多斯市西部四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列各组离子,在指定的环境中一定能大量共存的是
A.常温下,在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、NO3-、Na+
B.在能使石蕊变红色的溶液中:Na+、S2-、SO42-、CO32-
C.在加入铝粉能产生H2的溶液中:NH4+、Na+、NO3-、Cl-
D.常温下由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:K+、Cl-、NO3-、Na+
查看答案和解析>>
科目:高中化学 来源:2016届山东省青岛市高三上学期期中测试化学试卷(解析版) 题型:填空题
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2, 该反应的离子方程式为 。
(2)氢氧化铁与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(3)从海带中提取碘的过程中,下列说法正确的是

查看答案和解析>>
科目:高中化学 来源:2016届新疆兵团农二师华山中学高三上学期第二次月考化学试卷(解析版) 题型:实验题
氯化铁是常见的水处理剂。某氯化铁(FeCl3•6H2O)样品含有少量FeCl2杂质。现要测定其中FeCl3•6H2O的质量分数,实验按以下步骤进行:

已知有关离子方程式为:2Fe3++2I-═2Fe2++I2,I2+2S2O32-═2I-+S4O62-
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式为:________________________。
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、_________(填仪器名称)。
(3)操作II必须用到的仪器是________(选填编号);
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是__________________________。
(4)滴定时,消耗浓度为0.1000mol/L的标准Na2S2O3溶液18.00mL。该样品中FeCl3•6H2O(式量为270.5)的质量分数为_____________。
(5)要把样品氯化铁中的少量FeCl2杂质除去,可用的试剂是________(选填编号)。
a.铁粉 b.氯水 c.溴水 d.双氧水
(6)如果采用以下步骤测定氯化铁样品元素的含量,完成下列填空。
①称量样品 ②加水溶解 ③加足量氨水,沉淀 ④过滤 ⑤灼烧 ⑥称量并进行恒重操作。
还缺少的一步操作是________;在过滤前,需要检验是否沉淀完全,其操作___________________;判断是否恒重的标准是_________________________。
查看答案和解析>>
科目:高中化学 来源:2016届四川省巴中市普通高中高三10月诊断性测试理综化学试卷(解析版) 题型:填空题
(1)侯德榜制碱法生产流程为:

①沉淀池中反应的化学方程式: ;
②检验产品碳酸钠中是否含有氯化钠的操作方法为: 。
③上述流程中物质X的分子式为 。
(2)实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
四种盐在不同温度下的溶解度表 (g/100g水)

④反应控制在30—35℃,是因为高于35℃ NH4HCO3会分解,低于30℃则反应速率降低,为控制此温度范围,通常采取的加热方法为___________________;
⑤加料完毕,保温30分钟,目的 ;
⑥静置后只析出NaHCO3晶体的原因 ;
⑦过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使 (填化学式)循环使用,回收得到NH4Cl晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com