
【题目】SO2和NOx是大气污染物的主要成分。防止空气污染,保卫“兰州蓝”是兰州市一项重要民生工程。利用下图所示装置(电极均为惰性电极)可以吸收SO2还可以用阴极排出的溶液吸收NO2。下列说法错误的是
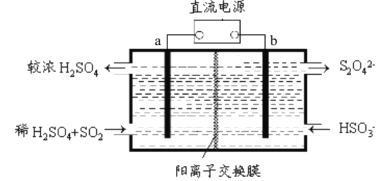
A. 电极a应连接电源的正极
B. 电极b上的电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O
C. 反应过程中,H+从a极室流向b极室
D. 每吸收标况下22.4LSO2,在b极室生成2NA个S2O42-
【答案】D
【解析】A项,由图可得,该装置为电解池,a极:SO2发生氧化反应,SO2+2H2O-2e-=4H++SO42-,所以电极a应连接电源的正极,故A正确;B项,由上述分析可推出b为阴极,HSO3-发生还原反应生成S2O42-,根据电荷守恒、原子守恒,并结合电解质溶液酸碱性,电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O,故B正确;C项,电解池中阳离子移向阴极,又因为阳离子交换膜把a极室与b极室隔开,所以反应过程中,H+从a极室(阳极室)流向b极室(阴极室),故C正确;D项,阳极反应为:SO2+2H2O-2e-=4H++SO42-,阴极反应为:2HSO3-+2e-+2H+=S2O42-+2H2O,根据得失电子守恒,每吸收标况下22.4LSO2(即1molSO2),在b极室生成1mol(即NA个)S2O42-,故D错误。


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)cZ(g)△H 的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是 ( )
A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平 衡时,Z的物质的量分数不变
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.△H>0,m+n>c
D.温度不变,增大压强,平衡正向移动,达新平衡时,A的浓度比原平衡减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol. 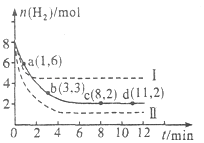
(1)a点正反应速率(填“大于”“等于”或“小于”)逆反应速率.
(2)下列时间段平均反应速率最大的是 .
A.O~1min
B.1~3min
C.3~8min
D.8~11min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中所示(虚线).曲线I对应的实验条件改变是 , 曲线Ⅱ对应的实验条件改变是 , 体积不变再充入3molCO2和4mol H2 , H2O(g)的体积分数(填“增大”“不变”或“减小”).
(4)若将1molCO2和3molH2充入该容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:①NO;②SiO2;③Cl2;④FeCl3,能与O2反应生成红棕色气体的是__________(填序号,下同);其水溶液具有漂白性的是___________;能与强碱反应的氧化物是_______;遇KSCN溶液变红色的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中的编号代表对应的元素。
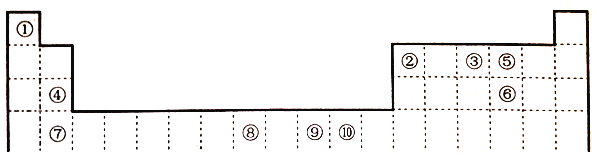
请回答:
(1)在周期表给出的10种元素中,电负性最小的元素基态原子的电子排布式为_____。
(2)在周期表给出的10种元素中,最外层未成对电子数与最外层成对电子数的个数比为3:2的元素与短周期最外层没有未成对电子数的元素形成的化合物是______(填化学式),所含化学键类型是_________。
(3)关于元素①与元素⑤形成的1:1的化合物,下列说法正确的是_____(填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1:1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(4)在①与③形成的相对分子质量最小的化合物A中,元素③的杂化类型是_____,写出与化合物A互为等电子体的一种阳离子_______(填离子符号)。
(5)元素⑧的+3价化合物MCl3·6H2O有三种不同颜色的异构体,为探究MCl3溶液析出的暗绿色晶体的化学式,取0.010molMCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870g,该晶体的化学式为_______(填字母序号)。
A.[M(H2O)6]Cl3 B.[M(H2O)5Cl]Cl2·H2O C.[M(H2O)4Cl2]Cl·2H2O
(6)元素⑩与元素⑤形成一种化合物其晶胞结构如下图所示,该化合物的化学式为____,若该晶体密度为dg/cm3,晶胞参数为apm,则阿伏加德罗常数的值NA为______。
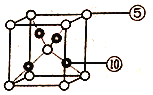
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.H2、SO2、CO2三种气体都可用浓H2SO4干燥
B.Fe(OH)3胶体无色、透明,能产生丁达尔现象
C.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
D.胶体和溶液的本质区别是能否产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为正丁烷的球棍模型。下列说法正确的是( )
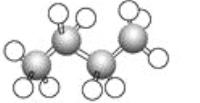
A. 正丁烷的分子式为C4H8
B. 分子中4个碳原子在同一条直线上
C. 分子中含有4个C—C单键
D. 分子中共含有13个共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com