
下列关于物质用途的叙述中,不正确的是( )
|
| A. | 硅可用于制作半导体材料 |
|
| B. | 二氧化硅可用于制造光导纤维 |
|
| C. | 石墨可用作绝缘材料 |
|
| D. | 液氨可用作制冷剂 |
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
下列说法不正确的是( )
|
| A. | 活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 |
|
| B. | 同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不相等 |
|
| C. | 将SO2气体通入BaCl2溶液中至饱和,未见沉淀生成,继续通入NO2则有沉淀生成 |
|
| D. | 除FeCl2溶液中的少量FeCl3,可用加入足量铁屑过滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则图中右侧Y形管中放置的药品组合不符合要求的是(必要是可以加热)( )
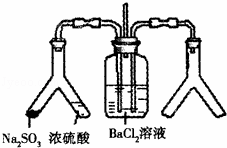
A. Cu和浓硝酸 B. CaO和浓氨水
C. 大理石和稀盐酸 D. 高锰酸钾溶液和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,发生下列几种反应①2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O ②Cl2+2NaBr=2NaCl+Br2 ③Br2+2FeBr2=2FeBr3根据上述反应,下列结论正确的是( )
A. 还原性强弱顺序为:Br﹣>Fe2+>Cl﹣
B. 氧化性强弱顺序为:MnO4﹣>Cl2>Br2>Fe3+
C. 反应①中,当生成1mol Cl2时,被氧化的HCl为3.2mol
D. 溶液中可发生反应:2Fe3++2Cl﹣=2Fe2++Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
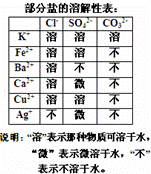
某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl﹣、CO32﹣、SO42﹣,现每次取该溶液100.00mL溶液进行以下实验:
①第一份加入AgNO3溶液发现有沉淀生成;
②第二份加足量BaCl2溶液生成沉淀,洗涤后干燥得沉淀6.27g,再将该沉淀加入足量盐酸溶解后再过滤洗涤干燥得沉淀2.33g.
请回答下列问题:
(1)根据以上实验判断,原溶液中可能存在的离子是 .
(2)原溶液中一定存在的阳离子是 ,其物质的量浓度至少为 mol/l.
(3)原溶液中一定存在的阴离子是﹣ ,其物质的量浓度分别为 mol/L、 mol/l.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学与生产、生活的认识不正确的是( )
|
| A. | CO2、CH4、N2等均是造成温室效应的气体 |
|
| B. | 使用清洁能源是防止酸雨发生的重要措施之一 |
|
| C. | 节能减排符合低碳经济的要求 |
|
| D. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明的溶液中可以大量共存的离子组是( )
|
| A. | Ba2+、K+、NO3﹣、SO42﹣ | B. | OH﹣、Cl﹣、Na+、NH4+ |
|
| C. | Mg2+、K+、Cl﹣、NO3﹣ | D. | Cu2+、NO3﹣、OH﹣、Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为 ;为了吸收该反应中产生的尾气,请选择下列中合适的装置 .
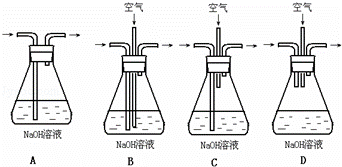
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂.将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4,即发生反应,生成硫酸铜.反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10﹣5mol•L﹣1,就认为沉淀完全),然后过滤、浓缩、结晶.
已知:Ksp≈10﹣22,Ksp≈10﹣16,Ksp≈10﹣38
请回答下列问题:
如开始加入的铜粉为3.2g,最后所得溶液为500mL,溶液中含有铁元素0.005mol.
①方案1中的B仪器名称是 .
②为了使铁元素全部沉淀,应调节pH至少为 .
③方案2中甲物质可选用的是 .
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 .
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45mL 1.5mol•L﹣1的稀硫酸中,控温在50℃.加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4•5H2O 10.5g.
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4•5H2O的产率为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com