
(8分)在下列反应中:
A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑
C.CaO+H2O=Ca(OH)2 D.2H2O=2H2↑+O2↑
(1)水只作氧化剂的是(填序号,下同) ,
(2)水只作还原剂的是 ,
(3)水既作氧化剂又作还原剂的是 ,
(4)水既不作氧化剂又不作还原剂的是 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年河南省南阳市上学期10月月考高二化学试卷(解析版) 题型:填空题
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 .
②Y电极上的电极反应式为 ,
③该反应的总反应方程式是: ﹣
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 .
②Y电极的材料是 ,电极反应式是 .
(3)若a为CuSO4溶液,则电解时的化学反应方程式为 、 通过一段时间后,向所得溶液中加入0.2molCu(OH)2粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .
(4)若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的C(H+)= (假设电解后溶液体积不变).
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南周口市高二上第一次月考化学(解析版) 题型:选择题
下列说法正确的是
A.其他条件不变,增大某一反应物浓度,反应物的转化率一定都增大
B.对于有气体参加的反应,其他条件不变增大压强,体积缩小,体系中各气体的浓度一定增大
C.对于有气体参加的反应,改变压强使平衡向右移动,生成的气体的浓度一定增大
D.增大反应物的浓度,平衡向右移动,生成物的体积分数一定增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列各组物质,按化合物、单质、混合物顺序排列的是
A、烧碱、液态氧、碘酒
B、生石灰、白磷、纯碱
C、干冰、铁、氯化氢
D、空气、氦气、胆矾
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列实验操作中错误的是
A.用规格为10 mL的量筒量取6 mL的液体
B.用药匙或者纸槽把粉末状药品送入试管的底部
C.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上
D.如果没有试管夹,可以临时手持试管给固体或液体加热
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一上学期期中化学试卷(解析版) 题型:选择题
已知 2Fe3+ +2I- =2Fe2+ +I2;2Fe2+ +Cl2 =2Fe3+ +2Cl-,则有关离子的还原性由强到弱的顺序为
A.Cl->Fe2+>I- B.Fe2+>I->Cl-
C.I->Fe2+>Cl- D.Fe2+>Cl->I-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一上学期期中化学试卷(解析版) 题型:选择题
下列各组物质,前者属于电解质,后者属于非电解质的是
A.NaCl晶体、BaSO4 B.铜、二氧化硫
C.硫酸、酒精 D.熔融的KNO3、硫酸溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高二上学期第三次月考化学试卷(解析版) 题型:填空题
(13分)碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x g钢样中的碳、硫转化为CO2、SO2。
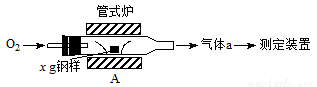
①气体a的成分是______。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2 1________+3________。
1________+3________。
(2)将气体a通入测硫装置中(如图),采用滴定法测定硫的含量。
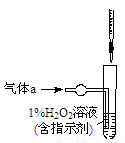
①H2O2氧化SO2的化学方程式:__________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液。若消耗1 mL NaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数:________。
(3)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:2H2(g)+O2(g)=2H2O(g) ΔH1=-d kJ·mol-1;
2C(s)+O2(g)=2CO(g) ΔH2=-e kJ·mol-1;
碳的燃烧热为f kJ·mol-1(d、e、f均大于0);
写出CO与水蒸气反应生成CO2和H2的热化学方程式:_______________________。
②将含SO2的烟气通过洗涤剂Y,再加入稀硫酸,既可以回收SO2,同时又可以得到化肥,上述洗涤剂Y可以是_______(填序号)。
a.Ca(OH)2 b.CaCl2 c.K2CO3 d.NaHSO3 e.NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高二上学期第一次月考化学试卷(解析版) 题型:选择题
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)  Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com