

| A. | 图1表示0.1000mol•L-1NaOH溶液滴定20.00ml 0.1000 mol•L-1醋酸溶液得到滴定曲线 | |
| B. | 图2所示在H2S溶液导电性实验中,曲线可确定通入的气体X为Cl2 | |
| C. | 图3在其它条件不变时,2SO2(g)+O2(g)?2SO3(g)转化关系中,纵坐标表示O2的转化率 | |
| D. | 由图4所示曲线可知,酶催化比化学催化的效果好 |
分析 A.醋酸为弱酸,没有滴入氢氧化钠溶液时,0.1000mol/L的醋酸溶液的pH大于1;
B.H2S+Cl2=S↓+2HCl反应弱电解质变化为强电解质,溶液导电能力增大;
C.由图象可知$\frac{n({O}_{2})}{n(S{O}_{2})}$越大,氧气转化率越大,实际应是$\frac{n({O}_{2})}{n(S{O}_{2})}$越大,SO2的转化率越大,氧气转化率越小;
D.催化剂是降低反应的活化能加快反应速率.
解答 解:A.0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1CH3COOH溶液,消氢氧化钠溶液体积为0时,醋酸为弱电解质,醋酸溶液的pH大于1,图象中醋酸的pH=1与实际不符,故A错误;
B.通入的气体X为Cl2反应,H2S+Cl2=S↓+2HCl中物质变化,弱电解质变化为强电解质,溶液导电能力增大,故B错误;
C.由图象可知$\frac{n({O}_{2})}{n(S{O}_{2})}$越大,氧气转化率越大,由反应2SO2(g)+O2(g)?2SO3(g),$\frac{n({O}_{2})}{n(S{O}_{2})}$越大,SO2的转化率越大,氧气转化率越小,图象与实际不相符,故C错误;
D.催化剂是降低活化能加快反应速率,酶催化作用对活化能降低的多,催化效果好,故D正确;
故选D.
点评 本题以图象的形式考查平衡移动、酸性比较、对反应速率的理解等,难度中等,需要学生具有扎实的基础与读图获取信息的能力.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉遇碘化钾溶液变蓝 | |
| B. | 葡萄糖和果糖互为同分异构体 | |
| C. | 利用油脂在碱性条件下水解可制取肥皂 | |
| D. | 用灼烧并闻气味的方法鉴别羊毛织物和棉织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键 | |
| B. | 元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B) | |
| C. | 往1.0 L 0.1 mol•L-1戊溶液中逐滴滴入同浓度的盐酸,立即产生大量气泡 | |
| D. | 1 mol甲与足量的乙完全反应共转移约1.204×l024个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2F2+2H2O═4HF+O2 | D. | SO2+H2O═H2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
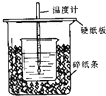 (1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
(1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:| 实验序号 | A | B | C |
| 加入试剂 | KMnO4、H2C2O4 | KMnO4、H2C2O4 1gMnSO4粉末 | KMnO4、H2C2O4 1gNa2SO4粉末 |
| 完全褪色时间/s | 116 | 6 | 117 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com