
【题目】如图是喷泉实验装置图,下列说法不正确的是
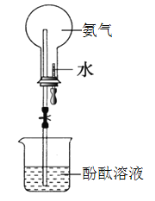
A.烧瓶中的溶液呈红色
B.该实验说明氨气可电离产生OH-
C.该实验说明氨气易溶于水
D.形成喷泉的原因是烧瓶内压强小于外界大气压
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为( )
A. 1mol/L B. 2 mol/L C. 0.5 mol/L D. 1.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol/L NaOH溶液滴定0.10mol/L HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示,下列叙述错误的是
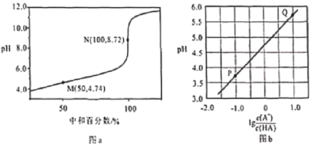
A. 当滴定至溶液呈中性时,c(A-)>c(HA)B. N点,c(Na+)·c(A-)=![]()
C. Ka(HA)的数量级为10-5D. P-Q过程中,水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
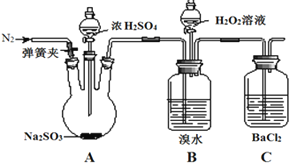
实验操作 | 实验现象 |
i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________。
(2)该实验可以证明SO2具有_________性;H2O2的氧化性_________Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________,B中重新变成红棕色的原因____________________________________(均用离子方程式表示)。
(4)C中产生的白色沉淀是______。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
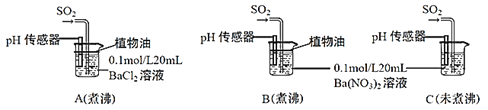
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________。若实验B、C中通入足量的SO2后,溶液酸性:B_________C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“解释或结论”与“实验操作及现象”不相符的一组是
序号 | 实验操作及现象 | 解释或结论 |
A | 浓硫酸滴到纸张上,纸变黑 | 浓硫酸有脱水性 |
B | 向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色 | 氯水中含有酸性物质和 漂白性物质 |
C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 该溶液中一定有CO32- |
D | 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有NH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在实验室探究Ba(OH)2溶液与稀盐酸反应的实质。向0.2mol/L Ba(OH)2溶液中滴加0.1mol/L盐酸,测定导电率的变化如图所示,回答下列问题:
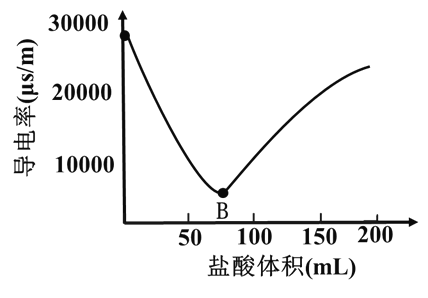
(1)Ba(OH)2在水中以离子形式存在的实验证据是___________。Ba(OH)2的电离方程式为___________。
(2)A-B段,发生的离子反应是__________。
(3)B点恰好完全反应,此时溶液中存在的微粒有H2O、__________。
(4)下列化学反应的实质与Ba(OH)2溶液与稀盐酸反应的实质相同的是__________。
A. Ba(OH)2和H2SO4 B. NaOH和H2SO4 C. Ba(OH)2与HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2,为了检验产物中的H2和CO(设气体均被充分吸收),设计如下实验装置。下列有关说法错误的是
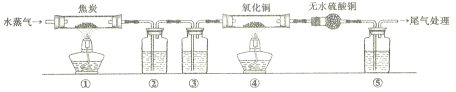
A. 为了实验安全,应先点燃①处酒精灯,后点燃④处酒精灯
B. ②、③、⑤中依次盛装氢氧化钠溶液、浓硫酸和澄清石灰水
C. ④中黑色固体变红色,即可证明产物中一定含有H2和CO中的一种或两种
D. 若用碱石灰替换无水硫酸铜,也可以达到检验H2和CO目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA 表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,4gH2含有的分子数为2NA
B.17g氨气所含电子数目为8NA
C.将1体积c1mol/L的硫酸溶于4体积水中 ,稀溶液的浓度为0.2c1mol/L
D.将5.85gNaCl 晶体溶入100mL水中,制得0.1mol/L的NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com