
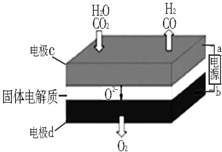
 综合利用CO2、CO对构建低碳社会有重要意义.
综合利用CO2、CO对构建低碳社会有重要意义.分析 (1)二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子;电极b氧离子失去电子发生氧化反应生成氧气;
(2)根据平衡常数的计算公式计算,恒温恒压下,体积之比等于物质的量之比,据此计算加入0.35molCO时容器的体积,计算此时浓度商,与平衡常数相比判断反应进行方向;
解答 解:(1)①CO2+H2O$\frac{\underline{\;高温\;}}{电解}$CO+H2+O2,二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,所以电极d为阳极,所以b为电源的正极,故答案为:正极;
②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,水中的氢元素化合价降低被还原,电极反应式为:H2O+2e-=H2+O2-,故答案为:CO2+2e-═CO+O2-;H2O+2e-=H2+O2-;
(2)CO(g)+2H2(g)?CH3OH(g)
起始:1.2mol 1mol 0
转化:0.4mol 0.8mol 0.4mol
平衡:0.8mol 0.2mol 0.4mol
所以:k=$\frac{0.2mol/L}{0.4mol/L×(0.1mol/L)^{2}}$=50(mol/L)-2,
此时向容器中再通入0.35molCO气体,假设平衡不移动时,此时容器体积为:2L×$\frac{(0.35+0.8+0.2+0.4)mol}{(0.8+0.2+0.4)mol}$=2.5L,则浓度商Qc=$\frac{\frac{0.4}{2.5}}{\frac{1.15}{2.5}×(\frac{0.2}{2.5})^{2}}$=54.3,大于平衡常数50,平衡向逆反应方向移动,
故答案为:50;逆反应方向.
点评 本题考查了热化学方程式和盖斯定律的计算和应用,电解池电极反应的分析书写,化学平衡常数的计算,原子守恒氧化还原反应的计算应用,题目难度中等


科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g)+nB(g) pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,一定能说明达到平衡状态的标志是( )
pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,一定能说明达到平衡状态的标志是( )
A.各组分的浓度不再改变
B.体系的压强不再改变
C.反应速率vA:vB:vC:vD=m:n:p:q
D.单位时间内m mol A断键发生反应,同时n mol B也断键发生反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、K+、OH-、Cl- B.Na+、Cu2+、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.Ba2+、HCO3-、NO3-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应生成氢氧化钠,则过氧化钠是碱性氧化物 | |
| B. | 钾、钠等碱金属着火时,立即用水或泡沫灭火器来灭火 | |
| C. | 用焰色反应可以检验钠的化合物跟钾的化合物 | |
| D. | 钠是一种还原性很强的金属,能把铜从硫酸铜溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
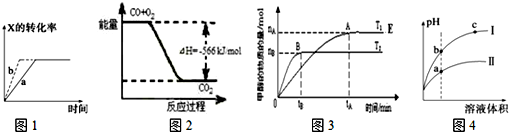
| A. | 图1所示,反应:X(g)+2Y(g)?3Z(g),b的压强一定比a大 | |
| B. | 图2表示CO生成CO2的反应过程和能量关系 | |
| C. | 图3表示反应CO+2H2?CH3OH(g),其中温度T2>T1,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的$\frac{1}{2}$,平衡正向移动,氢气浓度增大 | |
| D. | 图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡状态时A、B、C、D的反应速率均为0 | |
| B. | C的平均反应速率为:0.15mol/(L•min) | |
| C. | 充入N2使压强增大可加快反应速率 | |
| D. | 此时,V(A):V(B):V(C):V(D)=4:3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒容,充入N02气体,其转化率增大 | |
| B. | 加压,平衡向逆反应方向移动,混合气体颜色变深 | |
| C. | 若平衡常数增大,则可能是升高了温度或减小了体系的压强 | |
| D. | 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
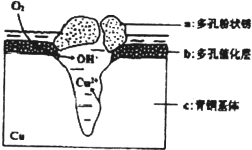 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
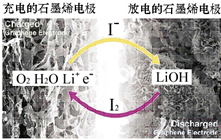 科学家开发出一种新型锂-氧电池,其能量密度极高,效率达90%以上.电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$ 2I2+4LiOH
科学家开发出一种新型锂-氧电池,其能量密度极高,效率达90%以上.电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$ 2I2+4LiOH| A. | 放电时负极上I- 被氧化 | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 充电时阴极反应为LiOH+e-═Li+OH- | |
| D. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com