
设NA代表阿伏伽德罗常数的述职,下列说法中正确的是( )
A、在标准状况下,33.6LSO3中含有的氧原子数是4.5NA
B、两份均为2.7g的铝样品分别为100mL浓度均为2mol·L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3 NA
C、常温常压下,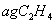 和
和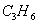 的混合气体中所含共用电子对数目为3a/14·NA
的混合气体中所含共用电子对数目为3a/14·NA
D、6.0g金刚石中含有的共价键数为2 NA
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1) ⑦元素最高价氧化物晶体类型是______________。
(2) ⑨所在族的各元素的氢化物中沸点最低的是________(写分子式)
(3)不同元素的原子在分子内吸引电子的能力大小可用电负性x来表示,若x越大说明该元素非金属性越强,比较x(⑧) x(⑨)(填>,< 或 =),写出一个支持这一比较的事实(用化学方程式表示) 。
(4) ①、④、⑤中的某两种或三种元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。
(5)元素③的氢化物与元素⑨的氢化物反应的化学方程式为 。已知第二周期ⅡA族元素性质与⑥相似,写出该元素最高价氧化物与NaOH溶液反应的离子方程式_________。
(6) 已知A为ⅡA族元素(第二到第七周期),其原子序数为a,B与A位于同一周期,且为ⅢA族元素,则B的原子序数b与a所有可能的关系是( )
A 、 b=a+1 B 、b=a+9 C、b=a+11 D、 b=a+15
(7) 由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应(已知Z为白色沉淀)
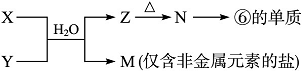
X溶液与Y溶液反应的离子方程式________, M中阳离子的检验方法____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据热化学方程式:S(g)+O2(g) SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
A.1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出QkJ的热量
B.1个S(g)与1个O2(g)完全反应要放出Q kJ的热量
C.S(s)+O2(g) SO2(g) △H<-Q kJ·mol-1
SO2(g) △H<-Q kJ·mol-1
D.1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
火柴头上通常含有氯酸钾、二氧化锰、硫等物质。某研究性学习小组进行火柴头中有关物质的实验探究。
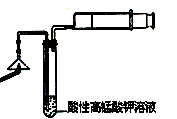 (1)检验火柴头中含有硫。
(1)检验火柴头中含有硫。
将两根火柴放在如右图所示实验装置中漏斗下方, 用 一根燃着的火柴点燃,慢慢拉动注射器活塞抽气,让火柴燃 烧产生的气体通入酸性高锰酸钾溶液,观察到高锰酸钾溶液 褪色,燃烧产生的气体中一定含有SO2。
①写出高锰酸钾溶液褪色为Mn2+的离子方程式:
② (填“能”或 “不能”)用紫色石蕊试液替代试管中的酸性高锰酸钾溶液来检验二氧化硫的存在。简述理由 。
(2)测定火柴头中KClO3的含量,主要实验步骤如下:
第一步:刮取火柴头,小心研碎,称得质量为2.450g;
第二步:用适量蒸馏水充分浸泡后 (填一种分离方法)、洗涤残渣;
第三步:往装有滤液和洗涤液的烧杯中加入过量NaNO2溶液、AgNO3溶液和稀硝酸,搅拌,充分反应后,过滤、洗涤沉淀;
第四步:干燥沉淀物,称得其质量为1.435g。
① 实验中发生的反应是:KClO3+3NaNO2+AgNO3=AgCl↓+3NaNO3+KNO3其中,NaNO2是 (填“氧化剂”或“还原剂”);反应中AgNO3、NaNO2均需要过量的原因是: 。
②实验测得火柴头中KClO3的质量分数为 。
③如果第三步中,未洗涤AgCl沉淀,测得KClO3的质量分数将 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)根据下图图示判断,下列说法正确的是( )
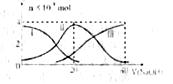 A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)> c(A2-)>c(OHˉ)
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)> c(A2-)>c(OHˉ)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.NaHA溶液中:c(OH-)+c(A2–)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH可能增大也可能减小
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相 同(选项中m、n均为正整数)。下列说法正确的是( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+ m,则X的最高正价一定为+ m
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池的两极分别为Pb、PbO2,电解液为硫酸,工作时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下面结论正确的是( )。
A.Pb为正极,被氧化 B.溶液的pH不断减小
C.SO42-只向PbO2处移动 D.电解液密度不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
某气态烃A,1 mol能与2 mol HCl完全加成生成B,B上的氢原子被Cl原子完
 全取代需要8 mol Cl2,则A可能是:( )
全取代需要8 mol Cl2,则A可能是:( )
A、丙炔 B、2-丁炔 C、2-丁烯 D、2-甲基丙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com