
�ס������ص缫���϶���������̼��������ͼ������ش��������⣺

��1���������о�ʢ��CuSO4��Һ����Ӧһ��ʱ���
���к�ɫ�����������ǣ��׳��е� �������ҳ��е� ����
�����ҳ��������ĵ缫��Ӧʽ�� ����
��2���������о�ʢ�ű���NaCl��Һ��
��д���׳��������ĵ缫��Ӧʽ ��
�ڽ�ʪ��ĵ���KI��ֽ�����ҳظ�����������ֽ��������һ��ʱ����ַ�����ɫ��ȥ��������Ϊ������Cl2�����ɵ�I2����������Ӧ��Cl2��I2�����ʵ���֮��Ϊ5��1�������������ᡣ�÷�Ӧ�Ļ�ѧ����ʽΪ ����
�����ҳ�ת��0.02mol���Ӻ�ֹͣʵ�飬������Һ�������200mL�����ʱ��Һ��pH= �����������ǵ���������Ӧ��
 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д� ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
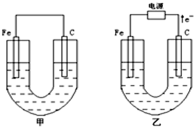 �ס������ص缫���϶���������̼������ش��������⣺
�ס������ص缫���϶���������̼������ش��������⣺
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ��ʾ���ס������ص缫���϶���������ʯī������ش��������⣺
��ͼ��ʾ���ס������ص缫���϶���������ʯī������ش��������⣺
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ��ʾ���ס������ص缫���϶���������̼������ش��������⣺
��ͼ��ʾ���ס������ص缫���϶���������̼������ش��������⣺
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |

| 1.77 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
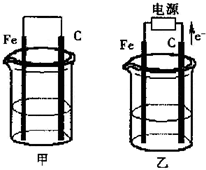 �ס������ص缫���϶���������̼������ͼ������ش��������⣺
�ס������ص缫���϶���������̼������ͼ������ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com