
【题目】下列说法正确的是 ( )
A. 一氧化二氮的摩尔质量是44 g B. 硫酸根的摩尔质量是96 g/mol
C. 1 mol O2的质量是32 g/mol D. 铁的摩尔质量就是铁的相对原子质量
科目:高中化学 来源: 题型:
【题目】2018年8月7日,PLOS Biology在线发表了关于玉米生物固氮的研究,为减少化肥使用和发展绿色农业提供重要的理论指导,固氮通常指将氮元素从游离态转化为化合态的过程。下列变化属于固氮的是
A.NH3→NOB.N2 → NH3
C.NO →NO2D.NO2→HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》记载了民间酿酒的工艺“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。以上用到的实验方法可应用于分离
A. 氯化钠和淀粉的混合溶液B. 汽油和煤油
C. 苯和氢氧化钠溶液D. 硝酸钾和氯化钠的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氢氧燃烧电池原理示意图,按照此图的提示,下列叙述正确的是( )
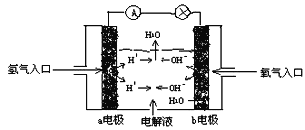
A. a电极是正极
B. b电极的电极反应为:4OH-- 4e-=2H2O + O2↑
C. 电子从a电极经由电解液传递到b电极
D. 氢氧燃烧电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 浓盐酸与铁屑反应:2Fe + 6H+= 2Fe3+ + 3H2↑
B. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4+ + OH-=NH3↑ + H2O
C. 往酸性碘化钾溶液中滴加适量的双氧水:2I- + 2H+ + H2O2 =I2 + 2H2O
D. HS-的电离:HS- + H2O = H3O+ + S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016杭州G20峰会期间,中美两国共同交存参加《巴黎协定》法律文书,展示了应对全球性问题的雄心和决心。其中燃煤、汽车、工业尾气排放等途径产生的CO、NOx的有效消除成为环保领域的重要课题。请根据题目提供信息回答相关问题。
Ⅰ.已知: N2(g) + O2(g) = 2NO(g) H = + 180.5 kJ·mol-1
2C(s) + O2(g) =2CO(g) H = - 221.0 kJ·mol-1
C(s) + O2(g) =CO2(g) H = - 393.5 kJ·mol-1
(1)汽车尾气转化器中发生的反应为:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g),此反应的H =____;
N2(g) + 2CO2(g),此反应的H =____;
(2)汽车燃油不完全燃烧时产生CO,有人设想选择合适的催化剂按下列反应除去CO:2CO(g) =2C(s) + O2(g),则该反应能否自发进行并说明理由:__________________。
Ⅱ.已知:用NH3催化还原NOx时包含以下反应。
反应①:4NH3(g) + 6NO(g) ![]() 5N2(g) + 6H2O(l) H1 < 0
5N2(g) + 6H2O(l) H1 < 0
反应②:4NH3(g) + 6NO2(g) ![]() 5N2(g) + 3O2(g) + 6H2O(l) H2 > 0
5N2(g) + 3O2(g) + 6H2O(l) H2 > 0
反应③:2NO(g) + O2(g) ![]() 2NO2(g) H3 < 0
2NO2(g) H3 < 0
(3)为探究温度及不同催化剂对反应①的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图所示。下列说法正确的是__________________ 。
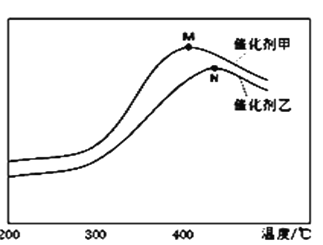
A.在催化剂甲的作用下反应的平衡常数比催化剂乙时大
B.反应在N点达到平衡,此后N2浓度减小的原因可能是温度升高,平衡向左移动
C.M点后N2浓度减小的原因可能是温度升高发生了副反应
D.M点后N2浓度减小的原因可能是温度升高催化剂活性降低了
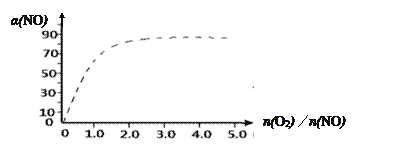
(4)图中虚线为反应③在使用催化剂条件下,起始O2、NO投料比和NO平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下,起始O2、NO投料比和NO平衡转化率的关系示意图。__________________
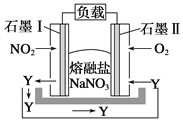
(5)由NO2、O2、熔融盐NaNO3组成的燃料电池如下图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,请写出石墨Ⅱ极的电极反应式:___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。下列有关说法正确的是
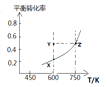
A. 该反应的正反应为放热反应
B. 600 K时,Y点甲醇的v(正)<v(逆)
C. 从Y点到Z点可通过增大压强实现
D. 从Y点到X点可通过使用催化剂实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com