
【题目】短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是
A. X、Z的最高价氧化物相互化合,生成的产物可用作防火剂
B. Y、Q形成的化合物是强电解质
C. 电解X、Q元素组成的化合物的饱和溶液常被用于实验室制备E单质
D. W、X、Q三种元素都能形成多种氧化物
【答案】C
【解析】
短周期W、X、Y、Z、Q五种元素的原子序数依次递增,已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,则W是C元素,Q是Cl元素;W和Z位于同一主族,则Z是Si元素;Y、Q形成一种共价化合物,Y的原子序数比Si小。,则Y只能是Al元素;X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E,则X是Na,2NaOH+H2O+Si=Na2SiO3+H2↑,E是H2,据此解答。
根据上述分析可知W、X、Y、Z、Q五种元素分别是W是C元素,X是Na元素,Y是Al元素,Z是Si元素,Q是Cl元素,单质E是H2。
A.X是Na,Z是Si元素,二者的最高价氧化物相互化合生成的产物是Na2SiO3,该物质不能燃烧,由于是离子化合物,分解需吸收大量的热,所以可用作防火剂,A正确;
B. Y是Al元素,Q是Cl元素,二者形成的化合物AlCl3是盐,在水中完全电离产生离子,因此该物质是强电解质,B正确;
C. X是Na元素,Q是Cl元素,电解X、Q元素组成的化合物NaCl的饱和溶液,方程式为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,但是该方法用于工业上制取氢气和氯气,而在实验室制备恰恰是用Zn与稀硫酸或稀盐酸反应制取,C错误;
Cl2↑+H2↑+2NaOH,但是该方法用于工业上制取氢气和氯气,而在实验室制备恰恰是用Zn与稀硫酸或稀盐酸反应制取,C错误;
D.W是C元素,它的氧化物有CO、CO2等;X是Na元素,钠的氧化物有Na2O、Na2O2;Q是Cl元素,其氧化物有ClO2、Cl2O5、Cl2O7等多种,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,还含有少量SiO2。现以卤块为原料按如图所示流程进行生产,用于制备金属镁。

请回答下列问题:
(1)步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施是____________(任写一条)。
(2)步骤②得到的X是___(填化学式),能够分离得到沉淀的方法是_____
(3)写出步骤④的化学方程式:_______
(4)步骤①中溶解卤块的盐酸如果过量太多造成的影响是____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有K+、Cl-、OH-、SO![]() 、SO
、SO![]() ,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是
①________,②________,③________,④__________,⑤__________。
(2)图中现象a、b、c表明检验出的离子分别是a________、b________、c________。
(3)白色沉淀A加试剂②反应的离子方程式_________________。
(4)无色溶液C加试剂③的主要目的是_____________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(6)气体E通入试剂④发生反应的离子方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王同学准备用CuSO4·5H2O配制500mL 1 mol/L的溶液。
(1)小王同学选用的玻璃仪器有:烧杯,玻璃棒,__________;________。
(2)玻璃棒在该实验中有重要的用途,分别是__________和 _________;
(3)小王同学通过计算,用托盘天平称取________gCuSO4·5H2O。
(4)物质的量浓度误差(填偏高、偏低、无影响)
①若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将_________;
②定容时,若眼睛俯视,则所配制的溶液浓度将___________;
③摇匀后以免低于刻度线,再加入少量水________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图象能正确反映其对应操作中各量变化关系的是 ( )
A.  用一定质量的高锰酸钾加热制氧气
用一定质量的高锰酸钾加热制氧气
B.  向一定质量的石灰石中加入过量的稀盐酸
向一定质量的石灰石中加入过量的稀盐酸
C.  向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体
向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体
D.  分别向等质量的铝和铁中加入溶质质量分数相同的稀盐酸至过量
分别向等质量的铝和铁中加入溶质质量分数相同的稀盐酸至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
(1)联氨分子的电子式为______________,
(2)联氨为二元弱碱,在水中的电离方式与氨相似。写出在水中联氨第一步电离反应的方程式______________________________________________________。
(3)已知12.8 g的液态高能燃料联氨在氧气中燃烧,生成气态N2和液态水,放出248.8kJ的热量。写出表示液态联氨燃烧热的热化学方程式___________________。
(4)已知①2O2(g)+N2(g)=N2O4(l) ;ΔH1
②N2(g)+2H2(g)=N2H4(l) ;ΔH2
③O2(g)+2H2(g)=2H2O(g) ; ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ;ΔH4
上述反应热效应之间的关系式为ΔH4=_________________,联氨和N2O4可作为火箭推进剂的主要原因为____________________________________________ (至少答2点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超顺磁性的Fe3O4粒子(粒子平均直径为25nm)在医疗上有重要作用,实验室制备方法如下:在有N2保护和剧烈搅拌条件下,向FeCl3、FeCl2混合溶液中滴加氨水,可得到黑色的Fe3O4。实验装置如图:
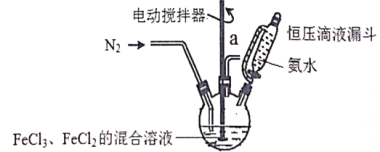
请回答下列问题:
(1)恒压滴液漏斗的优点是______________________。
(2)充N2的目的是___________,反应温度应控制在50℃,加热方法为___________。
(3)制备超顺磁性Fe3O4粒子反应原理的离子方程式为______________________。
(4)充分反应后,将三颈烧瓶中的混合物通过离心分离,然后水洗,最后用无水乙醇洗涤,用无水乙醇洗涤的优点是___________;为了验证得到的固体是超顺磁性的Fe3O4粒子,实验操作:_______________。为了检验超顺磁性粒子中含有+2价的铁,需要的化学试剂为___________(填代号)。
A.KSCN溶液 B.HCl溶液 C.H2O2溶液 D.K3[Fe(CN)6]溶液
(5)实验制得的超顺磁性的Fe3O4粒子中含有少量的Fe(OH)3,为测得Fe3O4的含量,称取mg试样,放在小烧杯中用足量稀硫酸溶解后定容于100mL容量瓶中,准确量取其中的20.00mL溶液置于锥形瓶中,然后用cmol/L的KMnO4溶液进行滴定,当______________________停止滴定,然后重复二次滴定,平均消耗KMnO4溶液ⅴmL,该样品的纯度为___________。(已知MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔质量是指单位物质的量的物质所含有的质量。
(1)已知NH3的相对分子质量为17,则NH3的摩尔质量为____。
(2)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为 ____。
(3)已知一个铁原子的质量为b g,则铁的摩尔质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,发生反应:①M(s)+N(g) R(g) ΔH= - Q1 kJ/mol
②2 R(g)+N(g) 2T(g) ΔH= - Q2 kJ/mol(已知Q1、Q2、Q3均为正值)
下列说法正确的是
A. 1molR(g)的能量总和大于1molM(s)与1molN(g)的能量总和
B. 将2mol R(g)与1molN(g)充分混合,在一定条件下充分反应,放出热量Q2 kJ
C. 当1molM(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+0.5Q2)kJ
D. M(g)+N(g) R(g) ΔH= - Q3 kJ/mol,则Q3 < Q1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com