
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 将苯滴入溴水中,振荡后水层接近无色 | |
| D. | 乙烯使KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长颈漏斗 | B. | 分液漏斗 | C. | 圆底烧瓶 | D. | 蒸馏烧瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | VL该气体的质量(以g为单位) | B. | 1L该气体中所含的分子数 | ||
| C. | 1mol该气体的体积(以L为单位) | D. | 1L该气体的质量(以g为单位) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
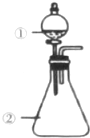 用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )| 选项 | ① | ② | 预测②中现象 | 实验结论 |
| A | 浓硫酸 | 浓盐酸 | 产生大量气体 | 硫酸的酸性比盐酸强 |
| B | 浓硫酸 | 铜片 | 铜片溶解,产生气泡,底部产生灰白色粉末 | 浓硫酸的酸性和强氧化性 |
| C | 浓硫酸 | CuSO4•5H2O | 固体由蓝色变为白色 | 浓硫酸具有吸水性,发生物理变化 |
| D | 浓硫酸 | 蔗糖 | 固体由白色变为黑色海绵状,并有刺激性气体放出 | 浓硫酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
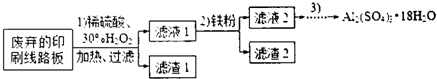
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| A13+ | 3.8 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
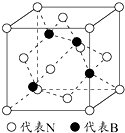 利用所学化学知识解答问题:
利用所学化学知识解答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com