
| A、等于2a% | B、大于2a% |
| C、小于2a% | D、无法确定 |
| 1000ρw% |
| M |
| 1000ρ1a% |
| M |
| 1000ρ2×w% |
| M |
| 1 |
| 2 |
| ρ1×a% |
| ρ2×w% |


科目:高中化学 来源: 题型:
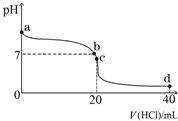 (1)有下列物质 ①Cu;②液氨;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦NH3?H2O;⑧NH4Cl属于弱电解质的是
(1)有下列物质 ①Cu;②液氨;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦NH3?H2O;⑧NH4Cl属于弱电解质的是| 化学式 | NH3?H2O | HCN | CH3COOH | H2CO3 |
| 电离平衡常数(25℃) | Kb=1.77×10-5 | Ka=4.93×10-10 | Ka=1.76×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2) |
| n(CO2) |

| A、该反应:△H>0 |
| B、氢碳比:①<②<③ |
| C、其它条件不变的情况下,缩小容器的体积可提高CO2的转化率 |
| D、若起始CO2浓度为2mol?L-1、H2为4mol?L-1,在图中曲线③氢碳比条件下进行,则400K时该反应的平衡常数数值约为1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCN难溶于水 |
| B、MnO2不能与HCN反应生成(CN)2 |
| C、HCN易形成白雾 |
| D、(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
| ||
. |
| A、+236 kJ?mol-1 |
| B、-236 kJ?mol-1 |
| C、+412 kJ?mol-1 |
| D、-412 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.0 mol |
| B、1.6 mol |
| C、1.2 mol |
| D、0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温度、同体积的N2和CO |
| B、同密度、同体积的H2和N2、 |
| C、同温度、同压强的C2H4和C3H6 |
| D、同质量、不同密度的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | KOH | HCl | NaCl | CaO | CO |
| C | NaOH | HClO | CaCl2 | CuO | SO2 |
| D | NaOH | HNO3 | BaCO3 | NO | SO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com