
| A. | 用 pH 试纸检验气体,一般先将 pH试纸用蒸馏水湿润,粘在玻璃棒的一端,并使其接近出气口,观察颜色的变化 | |
| B. | 检验 Fe3O4中是否含+2价铁元素时,先用盐酸溶解Fe3O4,再用 KMnO4溶液检验 | |
| C. | 海带中碘元素的提取和检验实验中为制取海带灰的浸取液,需要煮沸1-2min,其主要目的是赶走溶液中的溶解氧,避免氧气氧化碘离子 | |
| D. | 检验麦芽糖水解的产物时,先向水解后的溶液中加入氢氧化钠溶液至碱性,再加入新制的银氨溶液并水浴加热 |
分析 A.用pH试纸可以测出酸碱性,但不能测pH值;
B.含+2价铁元素,具有还原性,利用氧化还原反应分析;
C.煮沸的目的是为了加快碘化物在水中的溶解;
D.麦芽糖水解生成葡萄糖,在碱性条件下与银氨溶液反应.
解答 解:A.用pH试纸可以测出酸碱性,但不能测pH值,需要先润湿,故A正确;
B.含+2价铁元素,具有还原性,紫色褪色可说明含亚铁离子,故B正确;
C.煮沸的目的是为了加快碘化物在水中的溶解,以使灰烬中的碘离子尽可能多的进入溶液,故C错误;
D.麦芽糖水解生成葡萄糖,在碱性条件下与银氨溶液反应,有银镜生成,故D正确.
故选C.
点评 本题综合考查化学实验方案的评价,涉及物质的检验、除杂等知识,题目难度不大,注意A项,为易错点.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:解答题
 (1)Cu2+能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形.
(1)Cu2+能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 观察放入金属Na是否产生气泡 | |
| B. | 观察滴入的紫色石蕊溶液是否变红 | |
| C. | 观察滴入的酸性KMnO4溶液是否褪色 | |
| D. | 观察插入的表面发黑的灼热铜丝是否变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、C
、C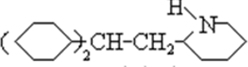 .
.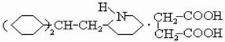 .
.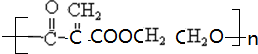 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 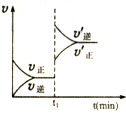 表示某吸热反应t1时刻升高温度时,正逆反应速率的变: | |
| B. | 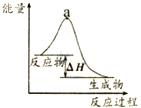 表示某放热反应过程的能量变化,若使用催化剂,a点会降低 | |
| C. | 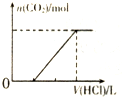 表示向含等物质的量的NaOH、Na2CO3混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | |
| D. | 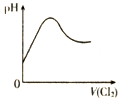 表示Cl2通入H2SO3溶液中pH的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉花和蛋白质都是高分子化合物,水解产物相同 | |
| B. | 苯和己烯都能使溴水褪色,均与溴水发生加成反应 | |
| C. | 可用碳酸氢钠溶液鉴别乙酸和乙醇 | |
| D. | 用溴水除去甲烷中混有的少量乙烷气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔和苯酚 | B. | 乙醇和乙酸 | C. | 甲醛和葡萄糖 | D. | 丙烯和丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com