
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,受热易分解。亚氯酸钠制备及部分性质实验如图:
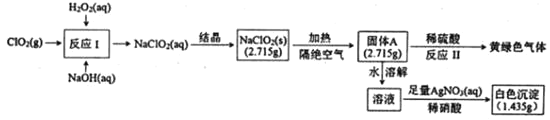
已知:①固体A为两种含氯盐组成的混合物:②AgClO3和AgcClO4都溶于水。
请回答:
(1)双氧水的电子式为___,固体A的成分是___(用化学式表示)。
(2)反应I的离子方程式为___。
(3)反应Ⅱ的化学方程式为___。
【答案】![]() NaCl、NaClO3 2ClO2+H2O2+2OH﹣=2ClO2﹣+O2↑+2H2O NaClO3+5NaCl+3H2SO4=3Na2SO4+3Cl2↑+3H2O
NaCl、NaClO3 2ClO2+H2O2+2OH﹣=2ClO2﹣+O2↑+2H2O NaClO3+5NaCl+3H2SO4=3Na2SO4+3Cl2↑+3H2O
【解析】
由实验可知,反应I中发生2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,然后结晶得到NaClO2(s),NaClO2隔绝空气加热可分解为NaClO3和NaCl,反应II中发生NaClO3+5NaCl+3H2SO4=3Na2SO4+3Cl2↑+3H2O,溶液与硝酸银反应生成的白色沉淀为AgCl。
(1)双氧水中氧原子最外层6个价电子,与另一个氧原子形成一对共用电子对,还有一个单电子与氢原子形成一个共用电子对,双氧水的结构式为H﹣O﹣O﹣H,电子式为![]() ,由流程图:NaClO2隔绝空气加热可分解为NaClO3和NaCl,固体A为两种含氯盐组成的混合物,固体A为NaCl、NaClO3;
,由流程图:NaClO2隔绝空气加热可分解为NaClO3和NaCl,固体A为两种含氯盐组成的混合物,固体A为NaCl、NaClO3;
(2)反应I的离子方程式为2ClO2+H2O2+2OH﹣=2ClO2﹣+O2↑+2H2O;
(3)反应Ⅱ的化学方程式为NaClO3+5NaCl+3H2SO4=3Na2SO4+3Cl2↑+3H2O。


科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上用铝土矿(主要成分为Al2O3、Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作流程如下:
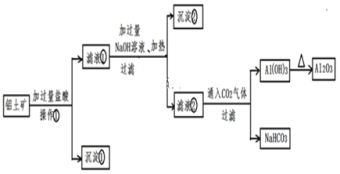
请回答下列问题:
(1)操作①的名称:____________;
(2)沉淀②的化学式:____________;
(3)写出沉淀①与NaOH溶液反应的化学方程式:__________;
(4)写出滤液②里通入过量CO2后生成沉淀的离子方程式: ______,能否将滤液②中通入过量CO2换成加入过量盐酸? ____ (填能或不能),其理由是_______(用化学方程式表示)。
Ⅱ.无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿为原料制备无水AlCl3的工艺流程如下:
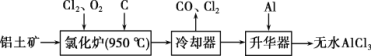
(1)铝在空气中有较强的抗腐蚀性,原因是___________________________。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式为___________________________。
(3)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16g无水AlCl3样品溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32g。
①写出上述除杂过程中涉及的离子方程式______________、_______________。
②产品中AlCl3的质量分数为___________。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
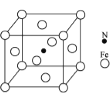
【题目】早期发现的一种天然二十面体准晶颗粒由Cu、Fe、Al三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_________方法区分晶体、准晶体和非晶体。
(2)基态Cu原子最高能层符号_________,Cu位于周期表________区;新制备的Cu(OH)2可将丙醛(CH3CH2CHO)氧化成丙酸,而自身还原成Cu2O,Cu2O中Cu元素的化合价为_________。1mol丙醛分子中含有的σ键的数目为_________,丙酸的沸点明显高于丙醛,其主要原因是_________________。
(3)已知:
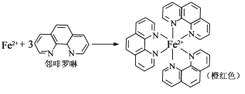
①Fe2+与邻啡罗啉形成的配合物(形成过程如图)中,配位体为_________________,配位原子数为__。
②铁能与氮形成一种磁性材料,其晶胞结构如图,则该磁性材料的化学式为___________。
③尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]。尿素分子中C、N原子的杂化方式分别是________、_________;与NO3-互为等电子体的一种化合物是_________(写化学式)。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为______,列式表示Al单质的密度_________________gcm﹣3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知乙烯能发生以下转化:
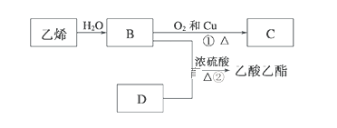
(1)B的结构简式为:________;
(2)C中官能团的名称:_______;
(3)①的反应类型:_________;
(4)乙烯与溴水反应的化学方程式为:__________;
(5)写出②的化学反应方程式:______________。
Ⅱ.今有相对分子质量为58的几种有机物,试写出符合条件的有机物的结构简式
(1)若该有机物为烃,则可能的结构简式为:_______、______。
(2)若该有机物是一种饱和一元醛,则其结构简式为:_______。
(3)若该有机物1mol能与足量银氨溶液作用可析出4molAg,则有机物的结构简式为:________。
(4)若该有机物能与金属钠反应,又能使溴的四氯化碳溶液褪色,则该有机可能是:______。(注羟基连在双键上的有机物极不稳定)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1mol·L—1NaOH溶液:K+、Na+、SO42--、CO32—
B. 0.1mol·L—1Na2CO3溶液:K+、Ba2+、NO3—、Cl—
C. 0.1mol·L—1AlCl3溶液:K+、NH4+、F—、SO42—
D. c(H+)/c(OH—) = 1×1014的溶液:Ca2+、Na+、ClO—、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
B. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C. N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
D. 水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1.3g乙炔和苯蒸汽混合气体中的碳氢键(C﹣H)数为0.1NA
B.一定条件下,2 molSO2与1 molO2反应生成的SO3分子数为2NA
C.1 L0.1 molL﹣1的乙酸溶液中含H+的数量为0.1NA
D.2.24L的CO和N2混合气体中含有的质子数为1.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法命名:
① 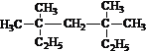 ___________________________;
___________________________;
②(CH3)2CHCH=CHCH3___________________________;
(2)写出下列各有机物的结构简式:
① 2,3-二甲基-4-乙基已烷 :_______________________________;
②支链只有一个乙基且相对分子质量最小的烷烃:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子的检验说法正确的是
A.向某溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有![]()
B.向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有![]()
C.向某无色溶液中加入少量稀氢氧化钠溶液后,用湿润的红色石蕊试纸靠近试管口,若试纸不变蓝,则说明该溶液中无![]()
D.如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com