
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
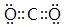 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程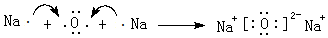 .
.分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为Si、⑨为S、⑩为Cl、⑪为K、⑫为Ca.
(1)金属性越强,单质与水反应越剧烈;非金属性越强,气体氢化物越稳定;同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)表中⑦元素形成的两性氢氧化物为氢氧化铝,⑥最高 价氧化物的水化物为NaOH,Al与氢氧化钠反应生成偏铝酸钠与氢气;
(3)②、④两种元素形成某气体化合物是导致温室效应的主要原因,该化合物为CO2;元素⑥形成的一种碱性氧化物为Na2O,属于离子晶体,用钠原子、氧原子电子式表示其形成;
(4)碳与浓硝酸在你加热条件下反应生成二氧化碳、二氧化氮与水.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为Si、⑨为S、⑩为Cl、⑪为K、⑫为Ca.
(1)上述元素中K的金属性最强,故与水反应最剧烈的金属元素是K,上述元素中F的非金属性最强,故氢化物中HF最稳定,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Si>N>O,
故答案为:K;HF;Si>N>O;
(2)表中⑦元素形成的两性氢氧化物为Al(OH)3,⑥最高价氧化物的水化物为NaOH,Al与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:Al(OH)3;2Al+2H2O+2OH-=2AlO2-+3H2↑;
(3)②、④两种元素形成某气体化合物是导致温室效应的主要原因,该化合物为CO2,电子式为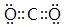 ,元素⑥形成的一种碱性氧化物为Na2O,属于离子晶体,用电子式表示其形成为
,元素⑥形成的一种碱性氧化物为Na2O,属于离子晶体,用电子式表示其形成为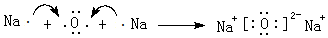 ,
,
故答案为: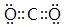 ;
;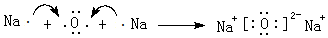 ;
;
(4)碳与浓硝酸在你加热条件下反应生成二氧化碳、二氧化氮与水,反应方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
点评 本题考查元素周期表与元素周期律、元素化合物性质、常用化学用语等,题目注重了基础知识的考查,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
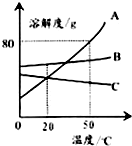
| A. | 50℃时A物质的溶解度最大 | |
| B. | 升温可使C物质的不饱和溶液变成饱和溶液 | |
| C. | 50℃时把90gA物质放入100g水中能得到190g溶液 | |
| D. | 将50℃三种物质的饱和溶液分别降温到20℃时,B溶液溶质质量分数最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16:9 | B. | 23:9 | C. | 1:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出5m3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸保存在用塑料盖的玻璃瓶中 | |
| B. | 稀硫酸可以用铁桶贮存 | |
| C. | 氯水盛放在棕色的玻璃瓶中 | |
| D. | 水玻璃保存在带有玻璃塞的玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
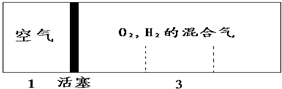
| A. | 2:7 | B. | 5:4 | C. | 1:1 | D. | 7:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com