
| A. | ③⑤ | B. | ①③⑥ | C. | ②④ | D. | ②③⑥ |
分析 ①盐酸少量生成碳酸氢钠,盐酸足量生成二氧化碳;
②硫化氢气体与氯化铁溶液发生氧化还原反应生成氯化亚铁、S、盐酸;
③二者反应生成氢氧化铝和硫酸铵;
④Fe不足,生成硝酸铁;Fe足量生成硝酸亚铁;
⑤氯水不足只氧化亚铁离子,氯水足量氧化亚铁离子、溴离子;
⑥反应生成碳酸钙和水.
解答 解:①碳酸钠与少量盐酸:Na2CO3+HCl=NaHCO3+NaCl;与过量盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,碳酸氢根离子在离子反应中保留化学式,其离子反应不同,故不选;
②硫化氢气体与氯化铁溶液发生氧化还原反应生成氯化亚铁、S、盐酸,离子反应只有一个,故选;
③只发生Al2(SO4)3+6NH3.H2O=2Al(OH)3↓+3(NH4)2SO4,离子反应只有一个,故选;
④Fe不足,生成硝酸铁;Fe足量生成硝酸亚铁,亚铁、铁离子不同,离子反应不同,故不选;
⑤氯水不足只氧化亚铁离子,氯水足量氧化亚铁离子、溴离子,离子反应不同,故不选;
⑥反应生成碳酸钙和水,离子反应均为HCO3-+Ca2++OH-=CaCO3↓+H2O,离子反应相同,故选;
故选D.
点评 本题考查离子反应的书写,为高频考点,把握与量有关的离子反应、离子反应中保留化学式的物质为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
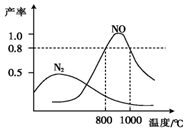 氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:| A. | v(N2)=v(NO) | |
| B. | 反应①的焓变△H保持恒定 | |
| C. | 体系的密度不再发生变化 | |
| D. | 混合气体的平均相对分子质量不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄淸石灰水,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入KSCN溶液无明显现象,再加入新制氯水溶液变为血红色,一定有Fe2+ | |
| D. | 加入过量硝酸银溶液,产生白色沉淀,再加入稀盐酸沉淀不溶解,则一定含有C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取12.12mL的盐酸 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 称量时,称量物应放在托盘天平的左盘,砝码放在托盘天平的右盘中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化产物与还原产物分子个数之比为15:1 | |
| B. | 氧化剂和还原剂是同一物质 | |
| C. | 反应过程中转移1mol电子,则产生2.24L气体(标准状况) | |
| D. | NaN3中氮元素的化合价为-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1-△H2 | B. | △H2-△H1 | C. | △H1+△H2 | D. | 2△H1-2△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1 mol/LHX溶液中pH=1 | |
| B. | Ksp(CaX2)随温度和浓度的变化而变化 | |
| C. | 该体系中,c(Cl-)=c(Ca2+) | |
| D. | 该体系中HX与CaCl2反应产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
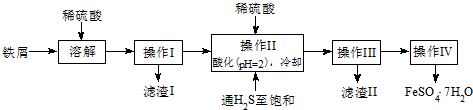
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com