
分析 (1)①该反应硝酸中部分N元素化合价由+5价变为+2、+4价,部分N元素化合价不变,据此判断硝酸性质;
②利用电子守恒来计算作氧化剂的硝酸的物质的量,作酸性和作氧化剂的物质的量之和为参加反应的硝酸的物质的量;
(2)①该反应中P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,根据转移电子守恒及原子守恒配平方程式;
②根据转移电子守恒计算硫酸铜氧化白磷的物质的量.
解答 解:(1)①该反应硝酸中部分N元素化合价由+5价变为+2、+4价,部分N元素化合价不变,所以硝酸体现氧化性和酸性,故答案为:氧化性和酸性;
②n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,
设NO的物质的量为n,得到的NO和NO2物质的量相同,
由电子守恒可知,0.3mol×2=n×(5-2)+n×(5-4),
解得n=0.15mol,
则N原子守恒可知作氧化剂的硝酸为0.15mol+0.15mol=0.3mol,
由Cu(NO3)2可知,作酸性的硝酸为0.3mol×2=0.6mol,
则参加反应的硝酸的物质的量是0.3mol+0.6mol=0.9mol,
故答案为:0.9mol;
(2)①反应中P元素的化合价由0价升高到+5价,Cl元素的化合价由+5价降低到-1价,根据得失电子数目相等可知二者计量数之比为3:10,则结合质量守恒定律可知平衡后的化学方程式为3P4+10HClO3+18H2O=10HCl+12H3PO4,故答案为:3;10;18H2O;10;12;
②30mol硫酸铜转移电子物质的量=30mol×(2-0)=60mol,氧化白磷物质的量=$\frac{60mol}{4×(5-0)}$=1.5mol,故答案为:1.5mol.
点评 本题考查氧化还原反应,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意从化合价的角度及电子守恒角度解答该题,难度不大


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫能使溴水褪色,说明二氧化硫具有漂白性 | |
| B. | 漂白粉和明矾都常用于处理自来水,二者的作用的原理相同 | |
| C. | 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可用酸性高锰酸钾溶液 | |
| D. | 金属单质Na、Al、Fe在一定条件下与水反应都生成氢气和对应的碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L O2一定含有NA个氧分子 | |
| B. | 1mol H2的质量只有在标准状况下才约为2g | |
| C. | 标准状况下,18g水的体积为22.4L | |
| D. | 1mol H2和O2的混合气体在标准状况下的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的pH一定是9 | B. | 该溶液的溶质可能是可水解的盐 | ||
| C. | 该溶液的溶质可能是酸或碱 | D. | 不可能有这样的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线: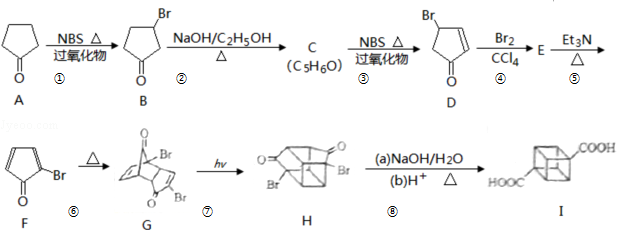
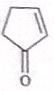 .
. $\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$
$\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$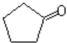 反应I的试剂与条件为Cl2/光照,反应2的化学方程式为
反应I的试剂与条件为Cl2/光照,反应2的化学方程式为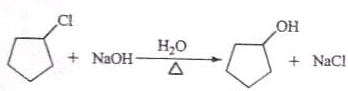 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.lmo/L的H2S溶液中:c(HS-)+c(S2-)=0.lmo/L | |
| B. | 常温下,100 mL pH=2的盐酸与10 mL pH=13的NaOH溶液混合,所得溶液pH=7 | |
| C. | 0.lmo/L CH3COOK溶液和0.lmo/L KOH溶液等体积混合,混合溶液中浓度大小关系是:c(K+)>c(CH3COO-)>c (OH-)>c(CH3COOH) | |
| D. | 0.lmo/L的三种溶液:①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2 Fe(SO4) 2 其c(NH4+)从大到小的顺序为:③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙中C的转化率为75% | |
| B. | 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正小于v逆 | |
| C. | 在该条件下,反应 2C(g)?A(g)+3B(g)的平衡常数为27×1.54(mol/L)2 | |
| D. | 乙中的热化学方程式为2C(g)?A(g)+3B(g);△H=+Q2kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com